
Sigma Link Comment il est formé, caractéristiques et exemples
le lien sigma (représenté par σ) est une union de type covalent, qui est caractérisée par le partage de deux électrons qui se produit entre une paire d'atomes pour former ladite liaison. De plus, il s'agit d'une sorte de liaison simple, dans laquelle les deux atomes sont liés par deux électrons pour former une seule liaison..
Lorsque deux ou plusieurs atomes sont combinés pour donner naissance à de nouveaux composés moléculaires, ils sont réunis au moyen de deux types de liaisons: ionique et covalente, dont la structure dépend de la façon dont les électrons sont partagés entre les deux atomes impliqués dans ce couplage..
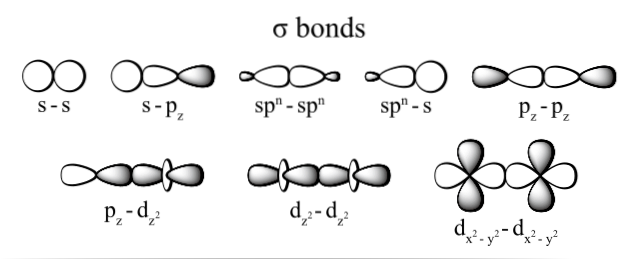
La connexion générée par les électrons est réalisée grâce au chevauchement des orbitales appartenant à chaque atome (par leurs extrémités), comprenant comme orbitales les espaces où il est le plus susceptible de localiser l'électron dans l'atome et qui sont définis par l'électron densité.
Index des articles
- 1 Comment se forme-t-il?
- 1.1 Formation de liaisons sigma dans différentes espèces chimiques
- 2 caractéristiques
- 3 exemples
- 4 Références
Comment se forme-t-il?
Typiquement, la liaison simple entre deux atomes est connue pour être équivalente à une simple liaison sigma..
De même, ces liaisons proviennent de la superposition ou du chevauchement de manière frontale qui se produit entre les extrémités des orbitales atomiques de deux atomes différents..
Ces atomes dont les orbitales se chevauchent doivent être adjacents les uns aux autres afin que les électrons individuels appartenant à chaque orbitale atomique puissent effectivement se lier et former la liaison..
D'où le fait que la distribution électronique qui se manifeste ou l'emplacement de la densité des électrons de chaque superposition a une symétrie cylindrique autour de l'axe qui se produit entre les deux espèces atomiques liées..
Dans ce cas, la soi-disant orbitale sigma peut être plus facilement exprimée en termes de liaisons intramoléculaires qui se forment dans les molécules diatomiques, notant qu'il existe également plusieurs types de liaisons sigma..
Les types de liaison sigma les plus couramment observés sont: dzdeux+rézdeux, s + pz, pz+pz et s + s; où l'indice z représente l'axe constitué par la liaison formée et chaque lettre (s, p et d) correspond à une orbitale.
Formation de liaisons sigma dans différentes espèces chimiques
Lorsqu'on parle d'orbitales moléculaires, on se réfère aux régions qui accumulent la densité électronique la plus élevée lorsqu'une liaison de ce type est formée entre différentes molécules, étant obtenue par la combinaison d'orbitales atomiques..
Du point de vue de la mécanique quantique, des études ont déduit que les orbitales de type moléculaire qui présentent un comportement symétriquement égal sont en réalité combinées dans des mélanges (hybridations)..
Cependant, la signification de cette combinaison d'orbitales est étroitement liée aux énergies relatives manifestées par des orbitales de type moléculaire qui sont symétriquement similaires..
Dans le cas des molécules organiques, on observe fréquemment des espèces cycliques constituées d'une ou plusieurs structures cycliques, qui sont fréquemment constituées d'un grand nombre de liaisons de type sigma en conjonction avec des liaisons de type pi (liaisons multiples)..
En fait, à l'aide de calculs mathématiques simples, il est possible de déterminer le nombre de liaisons sigma présentes dans une espèce moléculaire..
Il existe également des cas de composés de coordination (avec des métaux de transition), dans lesquels plusieurs liaisons sont combinées avec différentes classes d'interactions de liaison, ainsi que des molécules composées de différents types d'atomes (polyatomiques).
Caractéristiques
Les liaisons Sigma ont des caractéristiques uniques qui les différencient clairement des autres types de liaisons covalentes (liaison pi), parmi lesquelles le fait que ce type de liaison est la plus forte parmi les liaisons chimiques de la classe covalente.
En effet, le chevauchement entre les orbitales se produit directement, coaxialement (ou linéairement) et frontalement; c'est-à-dire qu'un chevauchement maximal est obtenu entre les orbitales.
De plus, la distribution électronique à ces jonctions est principalement concentrée entre les noyaux des espèces atomiques qui sont combinés..
Ce chevauchement des orbitales sigma se produit de trois manières possibles: entre une paire d'orbitales pures (s-s), entre une orbitale pure et un hybride de type (s-sp), ou entre une paire d'orbitales de type hybride (sp3- sp3).
L'hybridation se produit grâce au mélange d'orbitales d'origine atomique de différentes classes, obtenant que l'orbitale hybride résultante dépend de la quantité de chacun des types d'orbitales de départ pures (par exemple, sp3 = une orbitale s pure + trois orbitales pures de type p).
En plus de cela, la liaison sigma peut exister indépendamment, ainsi qu'admettre un mouvement de rotation libre entre une paire d'atomes..
Exemples
Étant donné que la liaison covalente est le type de liaison le plus courant entre les atomes, la liaison sigma se trouve dans un grand nombre d'espèces chimiques, comme on peut le voir ci-dessous..
Dans les molécules de gaz diatomiques - comme l'hydrogène (Hdeux), oxygène (Odeux) et azote (Ndeux) - différents types de liaisons peuvent se produire en fonction de l'hybridation des atomes.
Dans le cas de l'hydrogène, il existe une seule liaison sigma reliant les deux atomes (H-H), car chaque atome apporte son seul électron.
D'autre part, dans l'oxygène moléculaire, les deux atomes sont liés par une double liaison (O = O) -c'est-à-dire une liaison sigma- et une liaison pi, laissant chaque atome avec trois paires d'électrons restants appariés.
Au lieu de cela, chaque atome d'azote a cinq électrons dans son niveau d'énergie le plus externe (coquille de valence), ils sont donc joints par une triple liaison (N≡N), ce qui implique la présence d'une liaison sigma et de deux liaisons pi et d'une paire d'électrons appariés. dans chaque atome.
De la même manière, il se produit dans des composés de type cyclique à liaisons simples ou multiples et dans toutes sortes de molécules dont la structure est constituée de liaisons covalentes..
Les références
- Wikipédia. (s.f.). Obligation Sigma. Récupéré de en.wikipedia.org
- Chang, R. (2007). Chimie, neuvième édition. Mexique: McGraw-Hill.
- ThoughtCo. (s.f.). Définition de la chimie Sigma Bond. Récupéré de thinkco.com
- Britannica, E. (s.f.). Obligation Sigma. Récupéré de britannica.com
- LibreTexts. (s.f.). Obligations Sigma et Pi. Récupéré de chem.libretexts.org
- Srivastava, A. K. (2008). La chimie organique simplifiée. Récupéré de books.google.co.ve
Personne n'a encore commenté ce post.