
Caractéristiques, formation et exemples des épimères
Les épimères ce sont des diastéréoisomères dans lesquels un seul de leurs centres achiraux diffère par sa configuration spatiale; contrairement aux énantiomères, où tous les centres achiraux ont des configurations différentes, et représentent une paire d'images miroir qui ne peuvent pas être superposées les unes aux autres.
Le reste des diastéréoisomères (isomères géométriques, par exemple), peut avoir plus de deux centres avec des configurations différentes. Par conséquent, un grand pourcentage de stéréoisomères sont des diastéréoisomères; tandis que les épimères sont beaucoup moins, mais pas pour cette raison, moins importants.
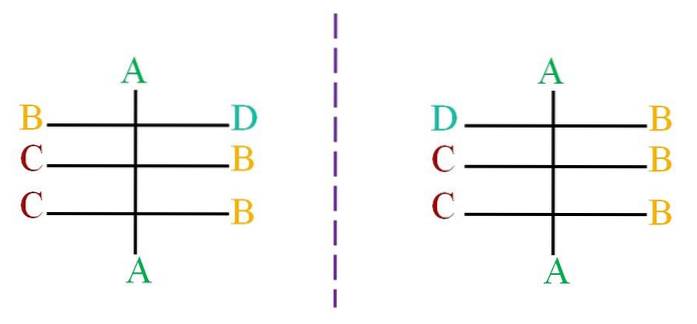
Supposons une structure avec un squelette d'atomes noirs liés aux lettres A, B, C et D (image du haut). La ligne pointillée représente le miroir, montrant que la paire de molécules ci-dessus ne sont pas des énantiomères, puisque tous leurs centres chiraux ont la même configuration; sauf, le premier centre, lié aux lettres B et D.
La molécule sur la gauche a la lettre D face au côté droit, tandis que la lettre de la molécule D sur la droite, fait face au côté gauche. Pour savoir quelle sera la configuration de chacun, utilisez le système Cahn-Ingold-Prelog (R-S).
Index des articles
- 1 Caractéristiques des épimères
- 2 Formation
- 2.1 Tautomérisation
- 3 exemples
- 3.1 Anomères de glucose
- 3.2 Isomères du menthol
- 4 Références
Caractéristiques des épimères
La principale caractéristique des épimères réside uniquement dans un centre achiral (ou stéréogène). Changer l'orientation spatiale de D et B peut conduire à des conformateurs plus stables ou instables; c'est-à-dire que les rotations des liaisons simples provoquent la rencontre ou l'éloignement de deux atomes ou groupes d'atomes volumineux.
De ce point de vue, un épimère peut être beaucoup plus stable que l'autre. Celui qui, en faisant tourner ses liaisons, génère des structures plus stables, sera l'épimère ayant la plus grande tendance à se former en équilibre..
Pour en revenir aux lettres, D et B peuvent être très volumineux, tandis que C est un petit atome. Ainsi, étant ainsi, l'épimère de droite est plus stable, puisque D et C situés à gauche des deux premiers centres souffrent moins d'encombrement stérique..
Au microscope, cela devient une caractéristique de la paire d'épimères considérée; mais macroscopiquement, les différences sont accentuées, et finissent par exemple par avoir des points de fusion, des indices de réfraction, des spectres RMN différents (en plus de nombreuses autres propriétés).
Mais dans le domaine de la biologie et des réactions catalysées par des enzymes, c'est là que les épimères diffèrent encore plus; l'un pourrait être métabolisé par l'organisme, tandis que l'autre ne l'est pas.
Formation
Comment se forment les épimères? Par une réaction chimique appelée épimérisation. Si les deux épimères ne diffèrent pas beaucoup en stabilité, un équilibre d'épimérisation est établi, qui n'est rien de plus qu'une interconversion:
EpA <=> EpB
Où EpA est l'épimère A et EpB est l'épimère B. Si l'un d'eux est beaucoup plus stable que l'autre, il aura une concentration plus élevée et provoquera ce que l'on appelle la mutarotation; c'est-à-dire qu'il pourra modifier la direction d'un faisceau lumineux polarisé.
L'épimérisation peut ne pas être équilibrée, et donc irréversible. Dans ces cas, on obtient un mélange racémique de diastéréoisomères EpA / EpB..
La voie de synthèse des épimères varie en fonction des réactifs impliqués, du milieu réactionnel et des variables du procédé (utilisation de catalyseurs, pression, température, etc.).
Pour cette raison, la formation de chaque paire d'épimères doit être étudiée individuellement par rapport aux autres; chacun avec ses propres mécanismes et systèmes chimiques.
Tautomérisation
Parmi tous les processus de formation d'épimères, la tautomérisation de deux diastéréoisomères peut être considérée comme un exemple général..
Il s'agit d'un équilibre où la molécule adopte une forme cétone (C = O) ou énol (C-OH). Une fois la forme cétone reconvertie, la configuration du carbone adjacent au groupe carbonyle (s'il est chiral) change, générant une paire d'épimères.
Un exemple de ce qui est mentionné ci-dessus est la paire cis-décalone et trans-décalone.
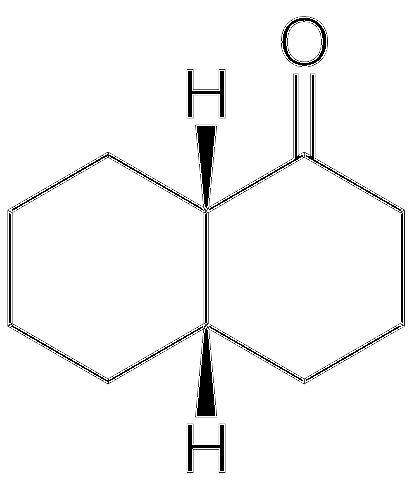
La structure de la cis-décalone est illustrée ci-dessus. Les atomes H sont au sommet des deux anneaux; tandis que dans le trans-decalone, l'un est au-dessus des anneaux et l'autre est en dessous. Le carbone à gauche du groupe C = O est le centre chiral, et donc, celui qui différencie les épimères.
Exemples
Anomères de glucose
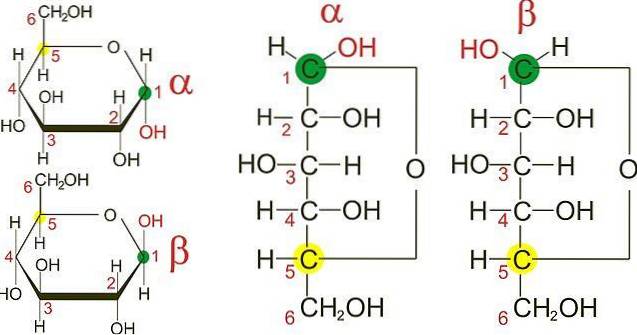
L'image du haut montre les anneaux de furane des deux anomères du D-glucose: α et β. A partir des anneaux, on peut voir que les groupes OH sur le carbone 1 se trouvent soit dans la même direction que l'OH adjacent, dans l'anomère α, soit dans des directions opposées, comme dans l'anomère β..
Les projections de Fisher des deux anomères (à droite de l'image) rendent encore plus claire la différence entre les deux épimères, qui sont eux-mêmes des anomères. Cependant, deux anomères α peuvent avoir des configurations spatiales différentes sur l'un des autres carbones, et donc être des épimères..
Dans le C-1 de la projection de Fisher pour l'anomère α, le groupe OH "regarde" vers la droite, tandis que dans l'anomère β il "regarde" vers la gauche..
Isomères du menthol

Dans l'image, vous avez tous les stéréoisomères de la molécule de menthol. Chaque colonne représente une paire d'énantiomères (à observer attentivement), tandis que les lignes correspondent aux diastéréoisomères.
Alors, que sont les épimères? Ce doivent être ceux qui ne diffèrent guère dans la position spatiale d'un seul carbone..
(+) - menthol et (-) - néoisomenthol sont des épimères, et de plus, des diastéréoisomères (ils ne sont pas dans la même colonne). Si observé en détail, dans les deux groupes -OH et -CH3 sortir du plan (au-dessus de l'anneau), mais dans le (-) - néoisomenthol le groupe isopropyle pointe également hors du plan.
Non seulement (+) - le menthol est l'épimère du (-) - néoisomenthol, mais aussi du (+) - néomenthol. Ce dernier ne diffère que par le fait que le groupe -CH3 pointe vers le bas de l'avion. Les autres épimères sont:
-(-) - isomenthol et (-) - néomenthol
-(+) - isomenthol et (+) - néomenthol
-(+) - néoisomenthol et (-) - néomenthol
-(+) - néomenthol et (-) - néoisomenthol
Ces stéréoisomères représentent un exemple pratique pour clarifier le concept d'épimères, et vous pouvez voir que, à partir de plusieurs diastéréoisomères, beaucoup ne peuvent se différencier qu'en un seul carbone asymétrique ou chiral..
Les références
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organique. (dixe édition.). Wiley plus.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Uruguay Salles de classe Educa. (s.f.). Epimers. Récupéré de: aulas.uruguayeduca.edu.uy
- Wikipédia. (2018). Epimer. Récupéré de: en.wikipedia.org/wiki/Epimer
- Fray J. M. (2014). Investigation of Epimer Formation in Amide-Coupling Reactions: An Experiment for Advanced Undergraduate Students. School of Chemistry, University of Nottingham, University Park, Nottingham NG7 2RD, Royaume-Uni. J. Chem. Educ. 2014, 91, 1, 136-140
- Reist et col. (Année mille neuf cents quatre-vingts-quinze). Racémisation, énantiomérisation, diastéréomérisation et épimérisation: leur signification et leur signification pharmacologique. Chiralité 7: 396-400.



Personne n'a encore commenté ce post.