
Propriétés de l'éthylène glycol, structure chimique, utilisations
le éthylène glycol c'est le composé organique le plus simple de la famille des glycols. Sa formule chimique est CdeuxH6OU ALORSdeux, tandis que sa formule structurelle est HOCHdeux-CHdeuxOH. Un glycol est un alcool caractérisé en ce qu'il a deux groupes hydroxyle (OH) attachés à deux atomes de carbone voisins dans une chaîne aliphatique.
L'éthylène glycol est un liquide clair, incolore et inodore. Dans l'image ci-dessous, vous avez un échantillon de lui dans un bocal. De plus, il a un goût sucré et est très hygroscopique. C'est un liquide légèrement volatil, il exerce donc une très faible pression de vapeur, la densité de la vapeur étant supérieure à la densité de l'air..

L'éthylène glycol est un composé avec une grande solubilité dans l'eau, en plus d'être miscible avec de nombreux composés organiques; tels que les alcools aliphatiques à chaîne courte, l'acétone, le glycérol, etc. Cela est dû à leur capacité à donner et à accepter des liaisons hydrogène provenant de solvants protiques (qui ont H).
L'éthylène glycol polymérise en de nombreux composés, dont les noms sont souvent abrégés en PEG et un nombre qui indique leur poids moléculaire approximatif. Le PEG 400, par exemple, est un polymère liquide relativement petit. Alors que les gros PEG sont des solides blancs avec un aspect gras.
La propriété de l'éthylène glycol d'abaisser le point de fusion et d'augmenter le point d'ébullition de l'eau, permet son utilisation comme liquide de refroidissement et anticoagulant dans les véhicules, les avions et les équipements informatiques.
Index des articles
- 1 Propriétés
- 1.1 Noms
- 1.2 Masse molaire
- 1.3 Apparence physique
- 1.4 Odeur
- 1.5 Saveur
- 1.6 Densité
- 1.7 Point de fusion
- 1.8 Point d'ébullition
- 1.9 Solubilité dans l'eau
- 1.10 Solubilité dans d'autres solvants
- 1.11 Point d'éclair
- 1.12 Densité de vapeur
- 1.13 Pression de vapeur
- 1.14 Décomposition
- 1.15 Température de stockage
- 1.16 Chaleur de combustion
- 1.17 Chaleur de vaporisation
- 1.18 Tension superficielle
- 1.19 Indice de réfraction
- 1,20 Constante de dissociation
- 1,21 pH
- 1.22 Coefficient de partage octanol / eau
- 2 Structure chimique
- 3 Production
- 3.1 Oxydation de l'éthylène
- 3.2 Hydrolyse de l'oxyde d'éthylène
- 3.3 Processus Omega
- 4 utilisations
- 4.1 Liquide de refroidissement et antigel
- 4.2 Déshydratation
- 4.3 Fabrication de polymères
- 4.4 Explosifs
- 4.5 Protection du bois
- 4.6 Autres applications
- 5 Empoisonnement et risques
- 5.1 Symptômes de l'exposition
- 5.2 Dommages par ingestion
- 5.3 Conséquences écologiques de l'éthylène glycol
- 6 Références
Propriétés
Des noms
Éthane-1,2-diol (IUPAC), éthylène glycol, monoéthylène glycol (MEG), 1-2-dihydroxyéthane.
Masse molaire
62,068 g / mol
Apparence physique
Liquide clair, incolore et visqueux.
Odeur
Toilette
Goût
Douce
Densité
1,1132 g / cm3
Point de fusion
-12,9 ºC
Point d'ébullition
197,3 ºC
Solubilité dans l'eau
Miscible à l'eau, composé hautement hygroscopique.
Solubilité dans d'autres solvants
Miscible avec les alcools aliphatiques inférieurs (méthanol et éthanol), le glycérol, l'acide acétique, l'acétone et les cétones similaires, les aldéhydes, la pyridine, les bases de goudron de houille et soluble dans l'éther. Pratiquement insoluble dans le benzène et ses homologues, les hydrocarbures chlorés, l'éther de pétrole et les huiles.
point d'allumage
111 ºC
Densité de vapeur
2.14 par rapport à l'air pris comme 1.
La pression de vapeur
0,092 mmHg à 25 ° C (par extrapolation).
Décomposition
Lorsqu'il est chauffé jusqu'à décomposition, il émet une fumée âcre et irritante.
Température de stockage
2 à 8 ºC
Chaleur de combustion
1 189,2 kJ / mol
Chaleur de vaporisation
50,5 kJ / mol
Tension superficielle
47,99 mN / m à 25 ºC
Indice de réfraction
1.4318 à 20 ºC
Constante de dissociation
pKa = 14,22 à 25 ºC
pH
6 à 7,5 (100 g / L d'eau) à 20 ºC
Coefficient de partage octanol / eau
Log P = - 1,69
Structure chimique
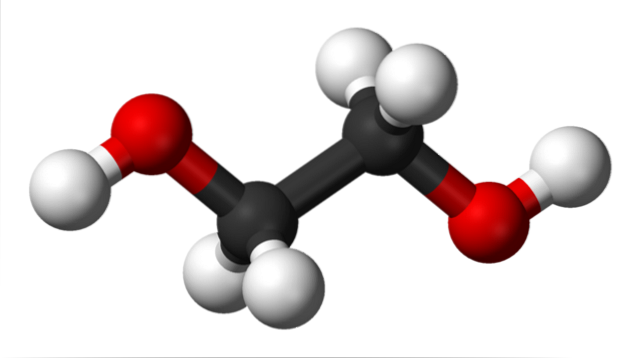
Dans l'image du haut, nous avons la molécule d'éthylène glycol représentée par un modèle de sphères et de barres. Les sphères noires correspondent aux atomes de carbone, qui composent leur squelette C-C, et à leurs extrémités nous avons les sphères rouge et blanche pour les atomes d'oxygène et d'hydrogène, respectivement..
C'est une molécule symétrique et à première vue on peut penser qu'elle a un moment dipolaire permanent; cependant, leurs liaisons C-OH tournent, ce qui favorise le dipôle. C'est aussi une molécule dynamique, qui subit des rotations et des vibrations constantes, et est capable de former ou de recevoir des liaisons hydrogène grâce à ses deux groupes OH..
En fait, ces interactions sont responsables de l'éthylène glycol ayant un point d'ébullition si élevé (197 ºC).
Lorsque la température descend à -13 ºC, les molécules se fondent dans un cristal orthorhombique, où les rotamères jouent un rôle important; c'est-à-dire qu'il existe des molécules dont les groupes O-H sont orientés dans des directions différentes.
Production
Oxydation de l'éthylène
L'étape initiale de la synthèse de l'éthylène glycol est l'oxydation de l'éthylène en oxyde d'éthylène. Dans le passé, l'éthylène était mis à réagir avec de l'acide hypochloreux pour produire de la chlorhydrine. Celui-ci a ensuite été traité avec de l'hydroxyde de calcium pour produire de l'oxyde d'éthylène..
La méthode à la chlorhydrine n'est pas très rentable et une méthode d'oxydation directe de l'éthylène en présence d'air ou d'oxygène a été adoptée, en utilisant de l'oxyde d'argent comme catalyseur..
Hydrolyse de l'oxyde d'éthylène
L'hydrolyse de l'oxyde d'éthylène (OE) avec de l'eau sous pression produit un mélange brut. Le mélange eau-glycol est évaporé et recyclé, séparant le monoéthylène glycol du diéthylène glycol et du triéthylène glycol par distillation fractionnée..
La réaction d'hydrolyse de l'oxyde d'éthylène peut être décrite comme suit:
CdeuxH4O + HdeuxO => OH-CHdeux-CHdeux-OH (éthylène glycol ou monoéthylène glycol)
Mitsubishi Chemical a développé un procédé catalytique, par l'utilisation de phosphore, dans la conversion de l'oxyde d'éthylène en monoéthylène glycol.
Processus Omega
Dans le procédé Omega, l'oxyde d'éthylène est initialement converti en carbonate d'éthylène, par sa réaction avec le dioxyde de carbone (COdeux). Ensuite, le carbonate d'éthylène est soumis à une hydrolyse catalytique pour obtenir le monoéthylène glycol avec une sélectivité de 98%..
Il existe une méthode relativement nouvelle pour la synthèse de l'éthylène glycol. Il s'agit de la carbonylation oxydative du méthanol en oxalate de diméthyle (DMO) et de son hydrogénation ultérieure en éthylène glycol..
Applications
Liquide de refroidissement et antigel
Le mélange d'éthylène glycol avec de l'eau permet une diminution du point de congélation et une augmentation du point d'ébullition, permettant aux moteurs de voiture de ne pas geler en hiver, ni de surchauffer en été.
Lorsque le pourcentage d'éthylène glycol dans le mélange avec de l'eau atteint 70%, le point de congélation est de -55 ºC, de sorte que le mélange éthylène glycol-eau peut être utilisé comme liquide de refroidissement et protection contre le gel dans les conditions dans lesquelles il peut se produire.
Les basses températures de congélation des solutions d'éthylène glycol permettent son utilisation comme antigel dans les moteurs d'automobiles; dégivrage des ailes d'aéronefs; et dans le dégivrage des pare-brise.
Il est également utilisé pour conserver des échantillons biologiques conservés à basse température, évitant ainsi la formation de cristaux pouvant endommager la structure des échantillons..
Le point d'ébullition élevé permet d'utiliser des solutions d'éthylène glycol pour maintenir de basses températures dans les appareils ou équipements qui génèrent de la chaleur lorsqu'ils fonctionnent, tels que: automobiles, équipements informatiques, climatiseurs, etc..
Déshydratation
L'éthylène glycol est un composé très hygroscopique, qui a permis son utilisation pour traiter les gaz extraits du sous-sol à forte teneur en vapeurs d'eau. L'élimination de l'eau des gaz naturels favorise leur utilisation efficace dans leurs processus industriels respectifs..
Fabrication de polymères
L'éthylène glycol est utilisé pour la synthèse de polymères, tels que le polyéthylène glycol (PEG), le polyéthylène téréphtalate (PET) et le polyuréthane. Les PEG sont une famille de polymères utilisés dans des applications telles que: l'épaississement des aliments, le traitement de la constipation, la cosmétique, etc..
Le PET est utilisé dans la production de toutes sortes de contenants jetables, qui sont utilisés dans différents types de boissons et d'aliments. Le polyuréthane est utilisé comme isolant thermique dans les réfrigérateurs et comme agent de remplissage dans différents types de meubles.
Explosifs
Il est utilisé dans la fabrication de la dynamite, ce qui permet qu'en ayant une diminution du point de congélation de la nitroglycérine, il puisse être stocké avec moins de risque..
Protection du bois
L'éthylène glycol est utilisé dans le traitement du bois pour le protéger de sa pourriture, produite par l'action des champignons. Ceci est important pour la préservation des œuvres d'art des musées.
Autres applications
L'éthylène glycol est présent dans les milieux de mise en suspension des sels conducteurs dans les condensateurs électrolytiques et dans les stabilisants de mousse de soja. Il est également utilisé dans la fabrication de plastifiants, d'élastomères et de cires synthétiques.
L'éthylène glycol est utilisé dans la séparation des hydrocarbures aromatiques et paraffiniques. De plus, il est utilisé dans la fabrication de détergents pour le nettoyage du matériel. Augmente la viscosité et diminue la volatilité de l'encre, ce qui facilite son utilisation.
De plus, l'éthylène glycol peut être utilisé dans la fonderie de sable de moulage et comme lubrifiant lors du broyage du verre et du ciment. Il est également utilisé comme ingrédient dans les fluides de freinage hydraulique et comme intermédiaire dans la synthèse d'esters, d'éthers, de fibres de polyester et de résines..
Parmi les résines dans lesquelles l'éthylène glycol est utilisé comme matière première se trouve l'alkyde, utilisé comme base de peintures alkyde, appliqué dans les peintures automobiles et architecturales..
Empoisonnement et risques
Symptômes de l'exposition
L'éthylène glycol a une faible toxicité aiguë lorsqu'il agit par contact avec la peau ou s'il est inhalé. Mais, sa toxicité se manifeste pleinement lors de l'ingestion, étant indiquée comme la dose mortelle d'éthylène glycol de 1,5 g / kg de poids corporel, soit 100 mL pour un adulte de 70 kg..
Une exposition aiguë à l'éthylène glycol produit les symptômes suivants: l'inhalation provoque une toux, des étourdissements et des maux de tête. Sur la peau, au contact de l'éthylène glycol, une sécheresse apparaît. Pendant ce temps, dans les yeux, il produit des rougeurs et des douleurs.
Dommages par ingestion
L'ingestion d'éthylène glycol se manifeste par des douleurs abdominales, des nausées, une perte de conscience et des vomissements. Une consommation excessive d'éthylène glycol a un effet néfaste sur le système nerveux central (SNC), la fonction cardiovasculaire et la morphologie et la physiologie des reins..
En raison de dysfonctionnements du système nerveux central, une paralysie ou des mouvements oculaires irréguliers (nystagmus) se produisent. Dans le système cardio-pulmonaire, il y a une pression artérielle élevée, une tachycardie et une possible insuffisance cardiaque. Il y a des altérations graves du rein, produit de l'intoxication à l'éthylène glycol.
Une dilatation, une dégénérescence et un dépôt d'oxalate de calcium se produisent dans les tubules rénaux. Cette dernière s'explique par le mécanisme suivant: l'éthylène glycol est métabolisé par l'enzyme lactique déshydrogénase pour produire du glycoaldéhyde.
Le glycoaldéhyde donne naissance aux acides glycolique, glyoxylique et oxalique. L'acide oxalique précipite rapidement avec le calcium pour former de l'oxalate de calcium, dont les cristaux insolubles se déposent dans les tubules rénaux, produisant des altérations morphologiques et des dysfonctionnements pouvant entraîner une insuffisance rénale..
En raison de la toxicité de l'éthylène glycol, il a été progressivement remplacé, dans certaines de ses applications, par du propylène glycol.
Conséquences écologiques de l'éthylène glycol
Los aviones durante su deshielo liberan cantidades importantes de etilenglicol, que terminan acumuladas en las pistas de aterrizajes, las cuales al ser lavadas produce que el agua traslade el etilenglicol, a través del sistema de drenado, hacia los ríos donde su toxicidad afecta la vida de les poissons.
Mais la toxicité de l'éthylène glycol n'est pas en soi la cause principale des dommages écologiques. Au cours de sa biodégradation aérobie, une quantité importante d'oxygène est consommée, provoquant sa diminution dans les eaux de surface.
D'autre part, sa biodégradation anaérobie peut libérer des substances toxiques pour les poissons, telles que l'acétaldéhyde, l'éthanol, l'acétate et le méthane..
Les références
- Wikipédia. (2019). Éthylène glycol. Récupéré de: en.wikipedia.org
- Centre national d'information sur la biotechnologie. Base de données PubChem. (2019). 1,2-éthanediol. CID = 174. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Artem Cheprasov. (2019). Éthylène glycol: structure, formule et utilisations. Étude. Récupéré de: study.com
- Leroy G. Wade. (27 novembre 2018). Éthylène glycol. Encyclopædia Britannica. Récupéré de: britannica.com
- A. Dominic Fortes et Emmanuelle Suard. (2011). Structures cristallines de l'éthylène glycol et du monohydrate d'éthylène glycol. J. Chem. Phys. 135, 234501. doi.org/10.1063/1.3668311
- Icis. (24 décembre 2010). Processus de production et de fabrication de l'éthylène glycol (EG). Récupéré de: icis.com
- Lucy Bell Young. (2019). Quelles sont les utilisations de l'éthylène glycol? Réactif. Récupéré de: Chemicals.co.uk
- QuimiNet. (2019). Origine, types et applications des éthylène glycols. Récupéré de: quiminet.com
- R. Gomes, R. Liteplo et M.E. Doux. (2002). Éthylène glycol: aspects de la santé humaine. Organisation mondiale de la santé, Genève. [PDF]. Récupéré de: who.int



Personne n'a encore commenté ce post.