
Propriétés, structure et utilisations de l'acide sulfurique (H2SO4)
le acide sulfurique (HdeuxSW4) C'est un composé chimique liquide, huileux et incolore, soluble dans l'eau avec dégagement de chaleur et corrosif pour les métaux et les tissus. Carbonise le bois et la plupart des matières organiques au contact de celui-ci, mais il est peu probable qu'il provoque un incendie.
L'acide sulfurique est peut-être le plus important de tous les produits chimiques industriels lourds et sa consommation a été citée à plusieurs reprises comme un indicateur de l'état général de l'économie d'un pays..

Une exposition à long terme à de faibles concentrations ou une exposition à court terme à des concentrations élevées peut entraîner des effets néfastes sur la santé. L'utilisation de loin la plus importante de l'acide sulfurique est dans l'industrie des engrais phosphatés.
D'autres applications importantes sont le raffinage du pétrole, la production de pigments, le décapage de l'acier, l'extraction de métaux non ferreux et la fabrication d'explosifs, de détergents, de plastiques, de fibres artificielles et de produits pharmaceutiques..
Index des articles
- 1 Vitriol, l'antécédent de l'acide sulfurique
- 2 Formule
- 3 Structure chimique
- 3.1 En 2D
- 3.2 En 3D
- 4 caractéristiques
- 4.1 Propriétés physiques et chimiques
- 4.2 Réactions avec l'air et l'eau
- 4.3 Inflammabilité
- 4.4 Réactivité
- 4.5 Toxicité
- 5 utilisations
- 5.1 Indirect
- 5.2 Direct
- 6 Le développement de l'industrie de l'acide sulfurique
- 6.1 Processus Vitriol
- 6.2 Chambres de plomb
- 7 Production actuelle: processus de contact
- 7.1 Processus de double contact
- 8 Matières premières utilisées dans la production d'acide sulfurique
- 8.1 Pyrite
- 8.2 Dioxyde de soufre
- 8.3 Recyclé
- 9 Effets cliniques
- 10 Sécurité et risques
- 10.1 Classes de danger du SGH
- 10.2 Codes des conseils de prudence
- 11 Références
Vitriol, l'antécédent de l'acide sulfurique
Dans l'Europe médiévale, l'acide sulfurique était connu sous le nom de vitriol, d'huile de vitriol ou de liqueur de vitriol par les alchimistes. Il a été considéré comme la substance chimique la plus importante, et il a été essayé d'être utilisé comme pierre philosophale.
Les Sumériens avaient déjà une liste de différents types de vitriol. De plus, Galien, le médecin grec Dioscoride et Pline l'Ancien ont évoqué son utilisation médicale.

Dans les travaux alchimiques hellénistiques, les utilisations métallurgiques des substances vitrioliques étaient déjà mentionnées. Le vitriol est un groupe de minéraux vitreux à partir desquels l'acide sulfurique peut être obtenu.
Formule
-Formule: HdeuxSW4
-Numero CAS: 7664-93-9
Structure chimique
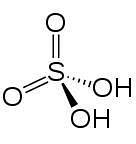
En 2D
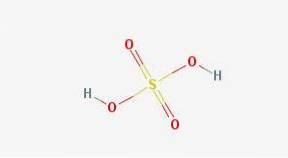
En 3d
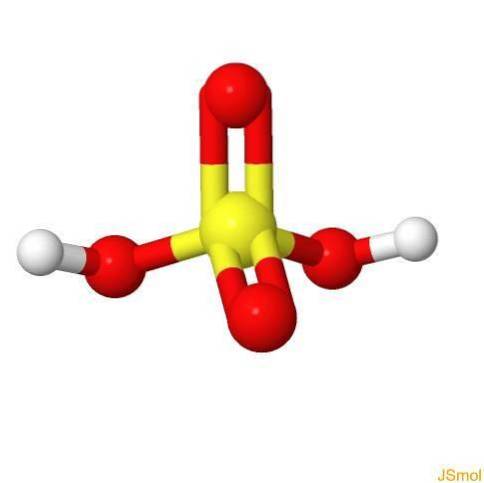
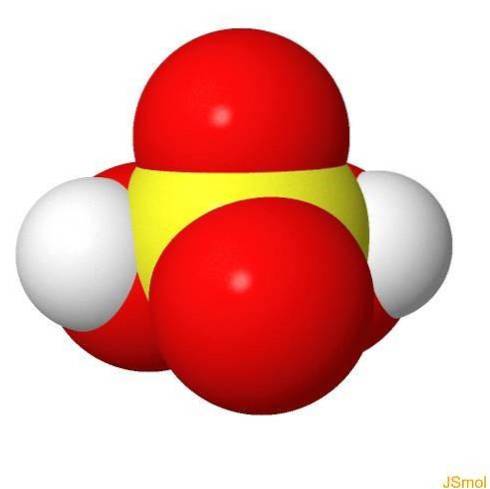
Caractéristiques
Proprietes physiques et chimiques

L'acide sulfurique appartient au groupe réactif des acides oxydants forts.
Réactions avec l'air et l'eau
- La réaction avec l'eau est négligeable sauf si l'acidité est supérieure à 80-90%, alors la chaleur d'hydrolyse est extrême, elle peut provoquer de graves brûlures.
Inflammabilité
- Les acides oxydants forts sont généralement ininflammables. Ils peuvent accélérer la combustion d'autres matériaux en fournissant de l'oxygène au site de combustion.
- Cependant, l'acide sulfurique est hautement réactif et capable d'enflammer des matériaux combustibles finement divisés lorsqu'il est en contact avec eux..
- Lorsqu'il est chauffé, il émet des fumées hautement toxiques.
- Il est explosif ou incompatible avec une grande variété de substances.
- Peut subir de violents changements chimiques à des températures et pressions élevées.
- Peut réagir violemment avec l'eau.
Réactivité
- L'acide sulfurique est fortement acide.
- Réagit violemment avec le pentafluorure de brome.
- Exploser avec du para-nitrotoluène à 80 ° C.
- Une explosion se produit lorsque de l'acide sulfurique concentré est mélangé avec du permanganate de potassium cristallin dans un récipient contenant de l'humidité. Il se forme de l'heptoxyde de manganèse qui explose à 70 ° C.
- Le mélange d'acrylonitrile et d'acide sulfurique concentré doit être conservé au réfrigérateur, sinon une réaction exothermique vigoureuse se produit.
- La température et la pression augmentent lorsque l'acide sulfurique (96%) est mélangé à parts égales dans un récipient fermé avec l'une des substances suivantes: acétonitrile, acroléine, 2-aminoéthanol, hydroxyde d'ammonium (28%), aniline, n-butyraldéhyde, chlorosulfonique acide, éthylène diamine, éthylèneimine, épichlorhydrine, éthylène cyanhydrine, acide chlorhydrique (36%), acide fluorhydrique (48,7%), oxyde de propylène, hydroxyde de sodium, monomère styrène.
- L'acide sulfurique (concentré) est extrêmement dangereux en contact avec les carbures, les bromates, les chlorates, les apprêts, les picrates et les métaux en poudre..
- Peut induire une polymérisation violente du chlorure d'allyle et réagit de manière exothermique avec l'hypochlorite de sodium pour produire du chlore gazeux.
- Le mélange d'acide chlorosulfurique et d'acide sulfurique à 98% donne du HCl.
Toxicité
- L'acide sulfurique est corrosif pour tous les tissus du corps. L'inhalation de vapeurs peut provoquer de graves lésions pulmonaires. Le contact avec les yeux peut entraîner une perte totale de la vision. Le contact avec la peau peut provoquer une nécrose sévère.
- Avaler de l'acide sulfurique, en une quantité comprise entre 1 cuillère à café et une demi-once du produit chimique concentré, peut être mortel pour un adulte. Même quelques gouttes peuvent être mortelles si l'acide pénètre dans la trachée.
- Une exposition chronique peut provoquer une trachéobronchite, une stomatite, une conjonctivite et une gastrite. Une perforation gastrique et une péritonite peuvent survenir et peuvent être suivies d'un collapsus circulatoire. Le choc circulatoire est souvent la cause immédiate du décès.
- Les personnes atteintes de maladies respiratoires, gastro-intestinales ou nerveuses chroniques et de maladies des yeux et de la peau courent un risque accru.
Applications
- L'acide sulfurique est l'un des produits chimiques industriels les plus utilisés au monde. Mais, la plupart de ses utilisations peuvent être considérées comme indirectes, participant comme réactif plutôt que comme ingrédient.
- La plupart de l'acide sulfurique finit sous forme d'acide utilisé dans la production d'autres composés ou sous forme de résidu de sulfate..
- Un certain nombre de produits contiennent du soufre ou de l'acide sulfurique, mais presque tous sont des produits spéciaux à faible volume..
- Environ 19% de l'acide sulfurique produit en 2014 a été consommé dans une vingtaine de procédés chimiques, et le reste a été consommé dans une grande variété d'applications industrielles et techniques.
- La croissance de la demande d'acide sulfurique dans le monde est due, par ordre décroissant, à la production de: acide phosphorique, dioxyde de titane, acide fluorhydrique, sulfate d'ammonium et dans le traitement de l'uranium et les applications métallurgiques.
Indirect
- Le plus gros consommateur d'acide sulfurique est de loin l'industrie des engrais. Elle représentait un peu plus de 58% de la consommation mondiale totale en 2014. Cependant, cette proportion devrait baisser à environ 56% d'ici 2019, principalement en raison d'une croissance plus forte des autres applications chimiques et industrielles..
- La production d'engrais phosphatés, en particulier l'acide phosphorique, est le principal marché de l'acide sulfurique. Il est également utilisé pour la fabrication de matériaux fertilisants tels que le triple superphosphate et les phosphates de mono et diammonium. De plus petites quantités sont utilisées pour la production de superphosphate et de sulfate d'ammonium.
- Dans d'autres applications industrielles, des quantités importantes d'acide sulfurique sont utilisées comme milieu de réaction de déshydratation acide, dans la chimie organique et les processus pétrochimiques impliquant des réactions telles que la nitration, la condensation et la déshydratation, ainsi que dans le raffinage du pétrole., Où il est utilisé dans le raffinage, alkylation et purification de distillats bruts.
- Dans l'industrie chimique inorganique, son utilisation est notable dans la production de pigments TiO2, d'acide chlorhydrique et d'acide fluorhydrique..
- Dans l'industrie de la transformation des métaux, l'acide sulfurique est utilisé pour le décapage de l'acier, la lixiviation des minerais de cuivre, d'uranium et de vanadium dans le traitement hydrométallurgique des minéraux et dans la préparation de bains électrolytiques pour la purification et le placage des métaux. ferreux.
- Certains procédés de fabrication de pâte de bois dans l'industrie papetière, dans la production de certains textiles, dans la fabrication de fibres chimiques et dans le tannage des peaux, nécessitent également de l'acide sulfurique.
Direct
- La plus grande utilisation d'acide sulfurique, dans laquelle le soufre est incorporé dans le produit final, est probablement dans le processus de sulfonation organique, en particulier pour la production de détergents..
- La sulfonation joue également un rôle important dans l'obtention d'autres produits chimiques organiques et de produits pharmaceutiques mineurs..
- Les batteries au plomb sont l'un des produits de consommation contenant de l'acide sulfurique les plus connus, ne représentant qu'une petite fraction de la consommation totale d'acide sulfurique..
- Dans certaines conditions, l'acide sulfurique est utilisé directement en agriculture pour la réhabilitation des sols fortement alcalins, comme ceux que l'on trouve dans les régions désertiques de l'ouest des États-Unis. Cependant, cette utilisation n'est pas très importante en termes de volume total d'acide sulfurique utilisé..
Le développement de l'industrie de l'acide sulfurique
Processus Vitriol

La méthode la plus ancienne pour obtenir de l'acide sulfurique est le «procédé au vitriol», qui repose sur la décomposition thermique de vitriols, qui sont des sulfates de divers types, d'origine naturelle..
Les alchimistes persans, Jābir ibn Hayyān (également connu sous le nom de Geber, 721-815 après JC), Razi (865-925 après JC) et Jamal Din al-Watwat (1318 après JC), ont inclus le vitriol dans leurs listes de classification des minéraux..
La première mention du "procédé au vitriol" apparaît dans les écrits de Jabir ibn Hayyan. Ensuite, les alchimistes St. Albert le Grand et Basilius Valentinus ont décrit le processus plus en détail. L'alun et la chalcanthite (vitriol bleu) ont été utilisés comme matières premières.
À la fin du Moyen Âge, l'acide sulfurique était obtenu en petites quantités dans des récipients en verre, dans lesquels le soufre était brûlé au salpêtre dans un environnement humide..
Le procédé au vitriol a été utilisé à l'échelle industrielle à partir du XVIe siècle en raison d'une plus grande demande d'acide sulfurique.
Vitriol de Nordhausen
Le centre de production était dans la ville allemande de Nordhausen (c'est pourquoi le vitriol a commencé à être appelé «Nordhausen vitriol»), où le sulfate de fer (II) (vitriol vert, FeSO4 - 7HdeuxO) comme matière première, qui a été chauffée, et le trioxyde de soufre résultant a été mélangé avec de l'eau pour obtenir de l'acide sulfurique (huile de vitriol).
Le procédé a été réalisé dans des galères, dont certaines avaient plusieurs niveaux, en parallèle, afin d'obtenir de plus grandes quantités d'huile de vitriol..
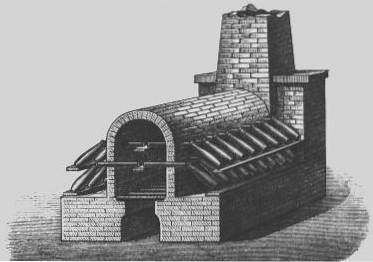
Chambres principales
Au 18ème siècle, un procédé plus économique pour la production d'acide sulfurique a été développé connu sous le nom de «procédé de chambre de plomb»..
Jusque-là, la concentration maximale d’acide obtenue était de 78%, alors qu’avec le «procédé vitriol» on obtenait de l’acide concentré et de l’oléum, cette méthode a donc continué à être utilisée dans certains secteurs de l’industrie jusqu’à l’apparition du «procédé de contact». en 1870, avec lequel l'acide concentré pouvait être obtenu moins cher.
Oleum ou acide sulfurique fumant (CAS: 8014-95-7), est une solution de consistance huileuse et de couleur brun foncé, avec une composition variable de trioxyde de soufre et d'acide sulfurique, qui peut être décrite par la formule HdeuxSW4.xSO3 (où x représente la teneur molaire libre en oxyde de soufre (VI)). Une valeur pour x de 1 donne la formule empirique HdeuxSdeuxOU ALORS7, correspondant à l'acide disulfurique (ou à l'acide pyrosulfurique).
Traiter
Le procédé en chambre de plomb était la méthode industrielle utilisée pour produire de l'acide sulfurique en grandes quantités, avant d'être supplanté par le "processus de contact".
En 1746 à Birmingham, en Angleterre, John Roebuck a commencé à produire de l'acide sulfurique dans des chambres doublées de plomb, qui étaient plus solides et moins chères que les récipients en verre précédemment utilisés, et pourraient être beaucoup plus grandes..
Le dioxyde de soufre (issu de la combustion de soufre élémentaire ou de minéraux métalliques contenant du soufre, comme la pyrite) a été introduit avec de la vapeur et de l'oxyde d'azote dans de grandes chambres revêtues de feuilles de plomb..
Le dioxyde de soufre et le dioxyde d'azote se sont dissous et, sur une période d'environ 30 minutes, le dioxyde de soufre a été oxydé en acide sulfurique..
Cela a permis l'industrialisation efficace de la production d'acide sulfurique et, avec divers raffinements, ce processus est resté la méthode de production standard pendant près de deux siècles..
En 1793, Clemente et Desormes ont obtenu de meilleurs résultats en introduisant de l'air supplémentaire dans le processus de la chambre de plomb..
En 1827, Gay-Lussac a introduit une méthode d'absorption des oxydes d'azote des gaz résiduaires de la chambre de plomb..
En 1859, Glover a développé une méthode de récupération des oxydes d'azote à partir d'acide nouvellement formé, par strippage avec des gaz chauds, ce qui a permis de réaliser en continu le processus de catalyse des oxydes d'azote..
En 1923, Petersen a introduit un processus de tour amélioré qui lui a permis d'être compétitif avec le processus de contact jusqu'aux années 1950..
Le procédé à chambre devint si robuste qu'en 1946, il représentait encore 25% de la production mondiale d'acide sulfurique..
Production actuelle: processus de contact
Le processus de contact est la méthode actuelle de production d'acide sulfurique à des concentrations élevées, nécessaire dans les processus industriels modernes. Le platine était le catalyseur de cette réaction. Cependant, le pentoxyde de vanadium (V2O5) est maintenant préféré.
En 1831, à Bristol, en Angleterre, Peregrine Phillips a breveté l'oxydation du dioxyde de soufre en trioxyde de soufre en utilisant un catalyseur au platine à des températures élevées..
Cependant, l'adoption de son invention et le développement intensif du procédé de contact n'ont commencé qu'après l'augmentation de la demande d'oléum pour la fabrication de colorant à partir de 1872 environ..
Ensuite, de meilleurs catalyseurs solides ont été recherchés, et la chimie et la thermodynamique de l'équilibre SO2 / SO3 ont été étudiées..
Le processus de contact peut être divisé en cinq étapes:
- Combinaison de soufre et de dioxygène (O2) pour former du dioxyde de soufre.
- Purification du dioxyde de soufre dans une unité de purification.
- Ajout d'un excès de dioxygène au dioxyde de soufre en présence d'un catalyseur au pentoxyde de vanadium, à des températures de 450 ° C et à une pression de 1 à 2 atm.
- Le trioxyde de soufre formé est ajouté à l'acide sulfurique donnant naissance à l'oléum (acide disulfurique).
- Oleum est ensuite ajouté à l'eau pour former de l'acide sulfurique qui est très concentré..
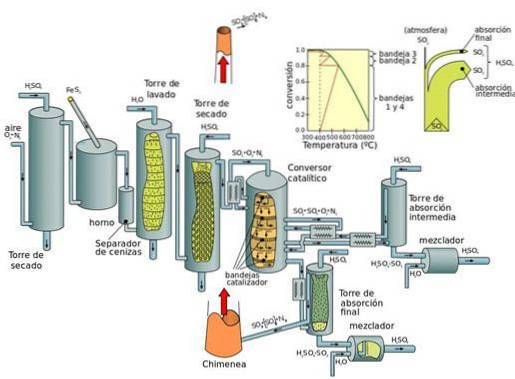
L'inconvénient fondamental des procédés à l'oxyde d'azote (pendant le procédé en chambre de plomb) est que la concentration d'acide sulfurique obtenue est limitée à un maximum de 70 à 75%, tandis que le procédé de contact produit de l'acide concentré (98%).
Avec le développement de catalyseurs au vanadium relativement peu coûteux pour le processus de contact, couplé à la demande croissante d'acide sulfurique concentré, la production mondiale d'acide sulfurique dans les usines de traitement d'oxyde d'azote a diminué régulièrement..
En 1980, pratiquement aucun acide n'était produit dans les usines de traitement d'oxyde d'azote en Europe occidentale et en Amérique du Nord..
Processus de double contact
Le processus de double absorption à double contact (DCDA ou Double Contact Double Absorption) a introduit des améliorations au processus de contact pour la production d'acide sulfurique.
En 1960, Bayer a déposé une demande de brevet pour le procédé dit de double catalyse. La première usine à utiliser ce procédé a été lancée en 1964.
En incorporant une étape d'absorption de SO3 Avant les étapes catalytiques finales, le processus de contact amélioré a permis une augmentation significative de la conversion du SO.deux , réduire considérablement ses émissions dans l'atmosphère.
Les gaz sont renvoyés à travers la colonne d'absorption finale, obtenant non seulement une performance de conversion de SO élevéedeux à SO3 (d'environ 99,8%), mais permettant également la production d'une concentration plus élevée d'acide sulfurique.
La différence essentielle entre ce processus et le processus de contact ordinaire réside dans le nombre d'étapes d'absorption..
À partir des années 1970, les principaux pays industrialisés ont introduit des réglementations plus strictes pour la protection de l'environnement et le processus de double prise en charge s'est généralisé dans les nouvelles usines. Cependant, le processus de contact conventionnel est encore utilisé dans de nombreux pays en développement avec des normes environnementales moins strictes..
La plus grande impulsion pour le développement actuel du processus de contact est axée sur l'augmentation de la récupération et de l'utilisation de la grande quantité d'énergie produite dans le processus..
En fait, une grande usine d'acide sulfurique moderne peut être considérée non seulement comme une usine chimique, mais aussi comme une centrale thermique..
Matières premières utilisées dans la production d'acide sulfurique
Pyrite
La pyrite était la matière première dominante dans la production d'acide sulfurique jusqu'au milieu du XXe siècle, lorsque de grandes quantités de soufre élémentaire ont commencé à être récupérées du processus de raffinage du pétrole et de la purification du gaz naturel, devenant ainsi la principale prime de l'industrie des matériaux..
Dioxyde de soufre
Actuellement, le dioxyde de soufre est obtenu par différentes méthodes, à partir de diverses matières premières.
Aux États-Unis, l'industrie est basée depuis les premières années du XXe siècle sur l'obtention de soufre élémentaire à partir de gisements souterrains par le "Frasch Process".
De l'acide sulfurique moyennement concentré est également produit par reconcentration et purification de grandes quantités d'acide sulfurique obtenues comme sous-produit d'autres procédés industriels..
Recyclage
Le recyclage de cet acide est de plus en plus important du point de vue de l'environnement, notamment dans les principaux pays développés..
La fabrication d'acide sulfurique à base de soufre élémentaire et de pyrite est, bien entendu, relativement sensible aux conditions du marché, puisque l'acide produit à partir de ces matériaux représente un produit primaire..
En revanche, lorsque l'acide sulfurique est un sous-produit, fabriqué comme moyen d'éliminer les déchets d'un autre procédé, le niveau de sa production n'est pas dicté par les conditions du marché de l'acide sulfurique, mais par les conditions du marché du produit primaire..
Effets cliniques
-L'acide sulfurique est utilisé dans l'industrie et dans certains produits de nettoyage ménagers, tels que les nettoyants pour salles de bains. Également utilisé dans les batteries.
-L'ingestion délibérée, en particulier de produits hautement concentrés, peut entraîner des blessures graves, voire mortelles. Ces expositions par ingestion sont rares aux États-Unis, mais sont répandues dans d'autres parties du monde..
-C'est un acide fort qui cause des lésions tissulaires et la coagulation des protéines. Il est corrosif pour la peau, les yeux, le nez, les muqueuses, les voies respiratoires et gastro-intestinales, ou tout autre tissu avec lequel il entre en contact..
-La gravité de la blessure est déterminée par la concentration et la durée du contact.
-Des expositions plus douces (concentrations inférieures à 10%) ne provoquent qu'une irritation de la peau, des voies respiratoires supérieures et de la muqueuse gastro-intestinale.
-Les effets respiratoires d'une exposition aiguë par inhalation comprennent: irritation du nez et de la gorge, toux, éternuements, bronchospasme réflexe, dyspnée et œdème pulmonaire. La mort peut survenir à la suite d'un collapsus circulatoire soudain, d'un œdème de la glotte et d'une atteinte des voies respiratoires, ou d'une lésion pulmonaire aiguë.
-L'ingestion d'acide sulfurique peut provoquer des douleurs épigastriques immédiates, des nausées, de la salivation et des vomissements de matière mucoïde ou hémorragique qui ressemble à du «marc de café». On observe parfois des vomissements de sang frais.
-L'ingestion d'acide sulfurique concentré peut entraîner une corrosion de l'œsophage, une nécrose et une perforation de l'œsophage ou de l'estomac, en particulier dans le pylore. Parfois, une lésion de l'intestin grêle est observée. Les complications ultérieures peuvent inclure une sténose et une formation de fistule. Après ingestion, une acidose métabolique peut se développer.
-Des brûlures cutanées graves peuvent survenir avec nécrose et cicatrisation. Ceux-ci peuvent être mortels si une zone suffisamment grande de la surface corporelle est affectée..
-L'œil est particulièrement sensible aux blessures par corrosion. L'irritation, le larmoiement et la conjonctivite peuvent se développer même avec de faibles concentrations d'acide sulfurique. Les éclaboussures d'acide sulfurique à fortes concentrations provoquent: des brûlures de la cornée, une perte de vision et parfois une perforation du globe.
-Une exposition chronique peut être associée à des modifications de la fonction pulmonaire, une bronchite chronique, une conjonctivite, un emphysème, des infections respiratoires fréquentes, une gastrite, une érosion de l'émail dentaire et éventuellement un cancer des voies respiratoires..
Sécurité et risques
Mentions de danger du Système général harmonisé de classification et d'étiquetage des produits chimiques (SGH)
Le Système général harmonisé de classification et d'étiquetage des produits chimiques (SGH) est un système internationalement reconnu, créé par les Nations Unies et conçu pour remplacer les diverses normes de classification et d'étiquetage utilisées dans différents pays en utilisant des critères cohérents au niveau mondial (Nations Unies, 2015 ).
Les classes de danger (et leur chapitre GHS correspondant), les normes de classification et d'étiquetage et les recommandations pour l'acide sulfurique sont les suivantes (Agence européenne des produits chimiques, 2017; Nations Unies, 2015; PubChem, 2017):
Classes de danger du SGH
H303: Peut être nocif en cas d'ingestion [Attention Toxicité aiguë, par voie orale - Catégorie 5] (PubChem, 2017).
H314: Provoque des brûlures de la peau et des lésions oculaires graves [Danger Corrosion cutanée / irritation cutanée - Catégorie 1A, B, C] (PubChem, 2017).
H318: Provoque des lésions oculaires graves [Danger Lésions oculaires graves / irritation oculaire - Catégorie 1] (PubChem, 2017).
H330: Mortel par inhalation [Danger Toxicité aiguë, inhalation - Catégorie 1, 2] (PubChem, 2017).
H370: Risque avéré d'effets graves pour les organes [Danger Toxicité spécifique pour certains organes cibles, exposition unique - Catégorie 1] (PubChem, 2017).
H372: Risque avéré d'effets graves pour les organes à la suite d'expositions répétées ou d'une exposition prolongée [Danger Toxicité spécifique pour certains organes cibles, exposition répétée - Catégorie 1] (PubChem, 2017).
H402: Nocif pour la vie aquatique [Dangereux pour le milieu aquatique, danger aigu - Catégorie 3] (PubChem, 2017).
Codes des conseils de prudence
P260, P264, P270, P271, P273, P280, P284, P301 + P330 + P331, P303 + P361 + P353, P304 + P340, P305 + P351 + P338, P307 + P311, P310, P312, P314, P320, P321, P363, P403 + P233, P405 et P501 (PubChem, 2017).
Les références
- Arribas, H. (2012) Schéma de la production d'acide sulfurique par la méthode de contact utilisant la pyrite comme matière première [image] Récupéré de wikipedia.org.
- Manuel d'économie chimique, (2017). Acide sulfurique. Récupéré de ihs.com.
- Chemical Economics Handbook, (2017.) Consommation mondiale d'acide sulfurique - 2013 [image]. Récupéré de ihs.com.
- ChemIDplus, (2017). Structure 3D de 7664-93-9 - Acide sulfurique [image] Récupéré de: chem.nlm.nih.gov.
- Codici Ashburnhamiani (1166). Portrait de "Geber" du 15ème siècle. Bibliothèque Laurenziana Medicea [image]. Récupéré de wikipedia.org.
- Agence européenne des produits chimiques (ECHA), (2017). Résumé de la classification et de l'étiquetage. Classification harmonisée - Annexe VI du règlement (CE) n ° 1272/2008 (règlement CLP).
- Banque de données sur les substances dangereuses (HSDB). TOXNET. (2017). Acide sulfurique. Bethesda, MD, UE: Bibliothèque nationale de médecine. Récupéré de: toxnet.nlm.nih.gov.
- Leyo (2007) Formule topologique de l'acide sulfurique [image]. Récupéré de: commons.wikimedia.org.
- Liebig's Extract of Meat Company (1929) Albertus Magnus, Chimistes Celebres [image]. Récupéré de: wikipedia.org.
- En ligne Müller, H. (2000). Acide sulfurique et trioxyde de soufre. Dans l'Encyclopédie d'Ullmann de chimie industrielle. Wiley-VCH Verlag GmbH & Co. KGaA. Disponible sur: doi.org.
- Nations Unies (2015). Système général harmonisé de classification et d'étiquetage des produits chimiques (SGH), sixième édition révisée. New York, UE: Publication des Nations Unies. Récupéré de: unece.org.
- Centre national d'information sur la biotechnologie. Base de données des composés PubChem, (2017). Acide sulfurique - Structure PubChem. [image] Bethesda, MD, UE: Bibliothèque nationale de médecine. Récupéré de: pubchem.ncbi.nlm.nih.gov.
- Centre national d'information sur la biotechnologie. Base de données des composés PubChem, (2017). Acide sulfurique. Bethesda, MD, UE: Bibliothèque nationale de médecine. Récupéré de: pubchem.ncbi.nlm.nih.gov.
- Administration nationale des océans et de l'atmosphère (NOAA). Produits chimiques CAMEO. (2017). Fiche technique chimique. Acide sulfurique épuisé. Silver Spring, MD. UE; Récupéré de: cameochemicals.noaa.gov.
- Administration nationale des océans et de l'atmosphère (NOAA). Produits chimiques CAMEO. (2017). Fiche technique chimique. Acide sulfurique. Silver Spring, MD. UE; Récupéré de: cameochemicals.noaa.gov.
- Administration nationale des océans et de l'atmosphère (NOAA). Produits chimiques CAMEO. (2017). Fiche technique du groupe réactif. Acides, oxydants forts. Silver Spring, MD. UE; Récupéré de: cameochemicals.noaa.gov.
- Oelen, W. (2011) Acide sulfurique 96% extra pur [image]. Récupéré de: wikipedia.org.
- Oppenheim, R. (1890). Schwefelsäurefabrik nach dem Bleikammerverfahren in der zweiten Hälfte des 19. Lehrbuch der Technischen Chemie [image]. Récupéré de: wikipedia.org.
- Priesner, C. (1982) Johann Christian Bernhardt und die Vitriolsäure, dans: Chemie in unserer Zeit. [photo]. Récupéré de: wikipedia.org.
- Stephanb (2006) Sulfate de cuivre [image]. Récupéré de: wikipedia.org.
- Stolz, D. (1614) Diagramme alchimique. Theatrum Chymicum [image] Récupéré de: wikipedia.org.
- Wikipédia, (2017). Acide sulfurique. Récupéré de: wikipedia.org.
- Wikipédia, (2017). Acide sulfurique. Récupéré de: wikipedia.org.
- Wikipédia, (2017). Bleikammerverfahren. Récupéré de: wikipedia.org.
- Wikipédia, (2017). Processus de contact. Récupéré de: wikipedia.org.
- Wikipédia, (2017). Processus de chambre de plomb. Récupéré de: wikipedia.org.
- Wikipédia, (2017). Oleum. Récupéré de: https://en.wikipedia.org/wiki/Oleum
- Wikipédia, (2017). Oleum. Récupéré de: https://es.wikipedia.org/wiki/%C3%93leum
- Wikipédia, (2017). Oxyde de soufre Récupéré de: wikipedia.org.
- Wikipédia, (2017). Processus Vitriol. Récupéré de: wikipedia.org.
- Wikipédia, (2017). Le dioxyde de soufre. Récupéré de: wikipedia.org.
- Wikipédia, (2017). Trioxyde de soufre. Récupéré de: wikipedia.org.
- Wikipédia, (2017). Acide sulfurique. Récupéré de: wikipedia.org.
- Wikipédia, (2017). Vitriolverfahren. Récupéré de: wikipedia.org.
- Wright, J. (1770) The Alchymist, In Search of the Philosopher's Stone, découvre le phosphore et prie pour la conclusion réussie de son opération, comme c'était la coutume des anciens astrologues chymiques. [image] Récupéré de: wikipedia.org.


Welcome to the world of adult Dating loveawake.ru