
Histoire, description et conclusions de l'expérience de Rutherford
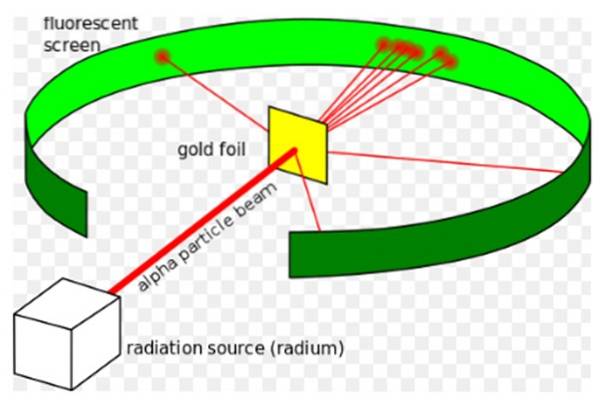
le Expérience de Rutherford, réalisée entre 1908 et 1913, elle consistait à bombarder une fine feuille d'or de 0,0004 mm d'épaisseur avec des particules alpha et à analyser le motif de dispersion que ces particules laissaient sur un écran fluorescent.
En fait, Rutherford a mené de nombreuses expériences, affinant de plus en plus les détails. Après avoir soigneusement analysé les résultats, deux conclusions très importantes ont émergé:
-La charge positive de l'atome est concentrée dans une région appelée cœur.
-Ce noyau atomique est incroyablement petit par rapport à la taille de l'atome.
Ernest Rutherford (1871-1937) était un physicien néo-zélandais dont le domaine d'intérêt était la radioactivité et la nature de la matière. La radioactivité était un phénomène récent lorsque Rutherford a commencé ses expériences, elle avait été découverte par Henri Becquerel en 1896.
En 1907, Rutherford est allé à l'Université de Manchester en Angleterre pour étudier la structure de l'atome, utilisant ces particules alpha comme sondes pour scruter l'intérieur d'une structure aussi minuscule. Les physiciens Hans Geiger et Ernest Marsden l'ont accompagné dans cette tâche..
Ils espéraient voir comment une particule alpha, qui est un atome d'hélium doublement ionisé, interagirait avec un seul atome d'or, pour s'assurer que toute déviation qu'elle subissait était uniquement due à la force électrique..
Cependant, la plupart des particules alpha ont traversé la feuille d'or avec seulement un léger écart..
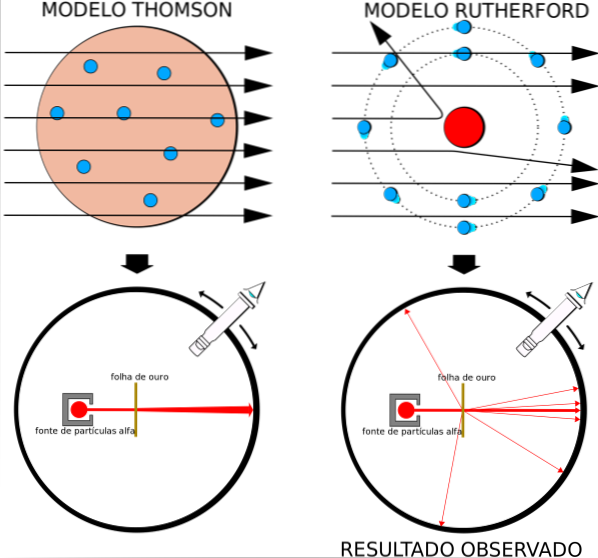
Ce fait était en accord total avec le modèle atomique de Thomson, cependant, à la surprise des chercheurs, un petit pourcentage des particules alpha a connu une déviation tout à fait remarquable..
Et un pourcentage encore plus petit de particules reviendrait, rebondissant complètement. Quels étaient ces résultats inattendus dus à?
Index des articles
- 1 Description et conclusions de l'expérience
- 1.1 Conclusions
- 2 Influences sur le modèle de l'atome
- 2.1 Inconvénients du modèle de Rutherford
- 2.2 Le proton et le neutron
- 3 Comment un modèle réduit de l'atome d'hydrogène?
- 4 Le modèle atomique aujourd'hui
- 5 Références
Description et conclusions de l'expérience
En fait, les particules alpha que Rutherford utilisait comme sonde sont des noyaux d'hélium, et à ce moment-là on savait seulement que ces particules étaient chargées positivement. Aujourd'hui, on sait que les particules alpha sont constituées de deux protons et de deux neutrons..
Les particules alpha et les particules bêta avaient été identifiées par Rutherford comme deux types différents de rayonnement de l'uranium. Les particules alpha, beaucoup plus massives que l'électron, ont une charge électrique positive, tandis que les particules bêta peuvent être des électrons ou des positrons..
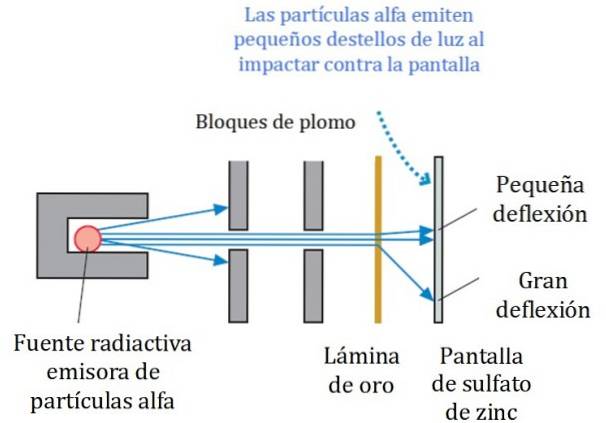
Un schéma simplifié de l'expérience est illustré à la figure 2. Le faisceau de particules alpha provient d'une source radioactive. Geiger et Marsden ont utilisé le radon comme émetteur.
Les blocs de plomb ont été utilisés pour diriger le rayonnement vers la feuille d'or et l'empêcher d'aller directement vers l'écran fluorescent. Le plomb est un matériau qui absorbe les radiations.
Le faisceau ainsi dirigé a ensuite été amené à heurter une fine feuille d'or et la plupart des particules ont continué leur chemin vers l'écran fluorescent au sulfate de zinc, où elles ont laissé une petite trace lumineuse. Geiger était chargé de les compter un par un, bien qu'ils aient ensuite conçu un appareil qui le faisait..
Le fait que certaines particules aient subi une petite déviation n'a pas surpris Rutherford, Geiger et Marsden. Après tout, il y a des charges positives et négatives sur l'atome qui exercent des forces sur les particules alpha, mais comme l'atome est neutre, ce qu'ils savaient déjà, les écarts devaient être faibles..
La surprise de l'expérience est que quelques particules positives ont été rebondies presque directement..
Conclusions
Environ 1 particule alpha sur 8 000 a été déviée à des angles supérieurs à 90 °. Peu, mais assez pour remettre en question certaines choses.
Le modèle atomique en vogue était celui du pudding aux raisins secs de Thomson, l'ancien professeur de Rutherford au laboratoire Cavendish, mais Rutherford se demandait si l'idée d'un atome sans noyau et avec des électrons incorporés sous forme de raisins secs, était correcte..
Car il s'avère que ces grandes déflexions de particules alpha, et le fait que quelques-unes sont capables de revenir, ne peuvent s'expliquer que si un atome a un petit noyau lourd et positif. Rutherford a supposé que seules les forces électriques attractives et répulsives, comme indiqué par la loi de Coulomb, étaient responsables de toute déviation..
Lorsque certaines des particules alpha s'approchent directement de ce noyau et que la force électrique varie avec l'inverse du carré de la distance, elles ressentent une répulsion qui leur cause la diffusion au grand angle ou la déviation vers l'arrière..
Certes, Geiger et Marsden ont expérimenté en bombardant des feuilles de différents métaux, pas seulement de l'or, bien que ce métal soit le plus approprié pour sa malléabilité, pour créer des feuilles très fines..
En obtenant des résultats similaires, Rutherford était convaincu que la charge positive de l'atome devait être localisée dans le noyau, et non dispersée dans tout son volume, comme le postulait Thomson dans son modèle..
D'autre part, comme la grande majorité des particules alpha passaient sans déviation, le noyau devait être très, très petit par rapport à la taille atomique. Cependant, ce noyau devait concentrer la majeure partie de la masse de l'atome.
Influences sur le modèle de l'atome
Les résultats ont grandement surpris Rutherford, qui a déclaré lors d'une conférence à Cambridge: «… C'est comme quand vous tirez un boulet de canon de 15 pouces sur une feuille de papier de soie et que le projectile rebondit droit sur vous et vous frappe.".
Comme ces résultats ne pouvaient pas être expliqués par le modèle atomique de Thomson, Rutherford a proposé que l'atome soit constitué d'un noyau, très petit, très massif et chargé positivement. Les électrons sont restés en orbite autour de lui, comme un système solaire miniature.
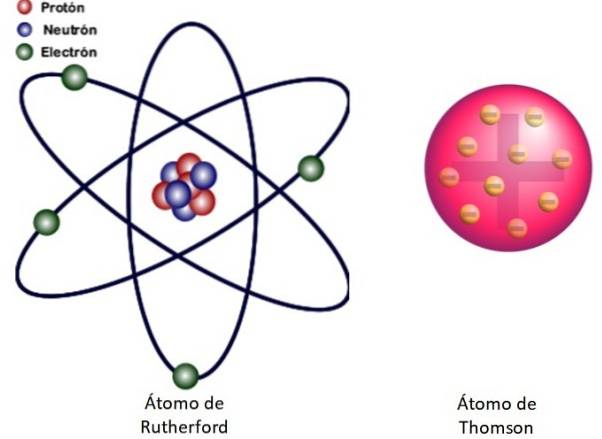
C'est en quoi consiste le modèle nucléaire de l'atome illustré à la figure 3 à gauche. Comme les électrons sont très, très petits aussi, il s'avère que l'atome est presque tout…. vider! Par conséquent, la plupart des particules alpha traversent la feuille à peine déviées..
Et l'analogie avec un système solaire miniature est très précise. Le noyau atomique joue le rôle du Soleil, contenant presque toute la masse plus la charge positive. Les électrons gravitent autour d'eux comme des planètes et portent une charge négative. L'ensemble est électriquement neutre.
Au sujet de la distribution des électrons dans l'atome, l'expérience de Rutherford n'a rien montré. Vous pourriez penser que les particules alpha auraient une certaine interaction avec elles, mais la masse des électrons est trop petite et ils n'ont pas pu dévier les particules de manière significative..
Inconvénients du modèle de Rutherford
Un problème avec ce modèle atomique était précisément le comportement des électrons.
Si celles-ci n'étaient pas statiques, mais en orbite autour du noyau atomique sur des orbites circulaires ou elliptiques, dirigées par attraction électrique, elles finiraient par tomber vers le noyau..
C'est parce que les électrons accélérés perdent de l'énergie, et si cela se produit, ce serait l'effondrement de l'atome et de la matière..
Heureusement, ce n'est pas ce qui se passe. Il existe une sorte de stabilité dynamique qui empêche l'effondrement. Le modèle atomique suivant, après celui de Rutherford, était celui de Bohr, qui a donné des réponses sur les raisons pour lesquelles l'effondrement atomique ne se produit pas..
Le proton et le neutron
Rutherford a continué à faire des expériences de diffusion. Entre 1917 et 1918, lui et son assistant William Kay ont choisi de bombarder les atomes d'azote gazeux avec les particules alpha hautement énergétiques du bismuth-214..
Il fut à nouveau surpris lorsqu'il détecta des noyaux d'hydrogène. Voici l'équation de la réaction, la première transmutation nucléaire artificielle jamais réalisée:
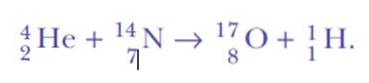
La réponse était: du même azote. Rutherford avait attribué à l'hydrogène le numéro atomique 1, car c'est l'élément le plus simple de tous: un noyau positif et un électron négatif.
Rutherford avait trouvé une particule fondamentale qu'il appela proton, un nom dérivé du mot grec pour premier. De cette manière, le proton est un constituant essentiel de chaque noyau atomique..
Plus tard, vers 1920, Rutherford proposa qu'il devait y avoir une particule neutre avec une masse très similaire à celle du proton. Il a appelé cette particule neutron et il fait partie de presque tous les atomes connus. Le physicien James Chadwick l'a finalement identifié en 1932.
Comment est un modèle réduit de l'atome d'hydrogène?
L'atome d'hydrogène est, comme nous l'avons dit, le plus simple de tous. Cependant, il n'a pas été facile de développer un modèle pour cet atome..
Des découvertes successives ont donné naissance à la physique quantique et à toute une théorie qui décrit les phénomènes à l'échelle atomique. Au cours de ce processus, le modèle atomique a également évolué. Mais jetons un œil à la question des tailles:
L'atome d'hydrogène a un noyau composé d'un proton (positif) et d'un seul électron (négatif).
Le rayon de l'atome d'hydrogène a été estimé à 2,1 x 10-dix m, tandis que celle du proton est de 0,85 x 10 -quinze m ou 0,85 femtomètres. Le nom de cette petite unité est dû à Enrico Fermi et est beaucoup utilisé pour travailler à cette échelle.
Eh bien, le quotient entre le rayon de l'atome et celui du noyau est de l'ordre de 105 m, c'est-à-dire que l'atome est 100 000 fois plus grand que le noyau!!.
Cependant, il faut tenir compte du fait que dans le modèle contemporain, basé sur la mécanique quantique, l'électron enveloppe le noyau dans une sorte de nuage appelé orbital (une orbitale n'est pas une orbite) et l'électron, à l'échelle atomique, n'est pas ponctuel.
Si l'atome d'hydrogène était agrandi - de manière imaginative - à la taille d'un terrain de football, alors le noyau composé d'un proton positif aurait la taille d'une fourmi au centre du champ, tandis que l'électron négatif serait comme une sorte de fantôme. , dispersés dans tout le champ et entourant le noyau positif.
Le modèle atomique aujourd'hui
Ce modèle atomique de «type planétaire» est très enraciné et est l'image que la plupart des gens se font de l'atome, car il est très facile à visualiser. Cependant, ce n'est pas le modèle accepté aujourd'hui dans le domaine scientifique.
Les modèles atomiques contemporains sont basés sur la mécanique quantique. Elle souligne que l'électron dans l'atome n'est pas un point chargé négativement qui suit des orbites précises, comme celles envisagées par Rutherford..
Au contraire, l'électron est éparpillé en zones, autour du noyau positif, appelées orbitales atomiques. De lui, nous pouvons savoir probabilité être dans un état ou un autre.
Malgré cela, le modèle de Rutherford a représenté une énorme avancée dans la compréhension de la structure intérieure de l'atome. Et cela a ouvert la voie à davantage de chercheurs pour continuer à l'affiner..
Les références
- Andriessen, M. 2001. Cours HSC. Physique 2. Jacaranda HSC Science.
- Arfken, G. 1984. Physique universitaire. Presse académique.
- Knight, R. 2017. Physique pour les scientifiques et l'ingénierie: une approche stratégique. Pearson.
- Physique OpenLab. L'expérience Rutherford-Geiger-Marsden. Récupéré de: physicsopenlab.org.
- Rex, A. 2011. Fondamentaux de la physique. Pearson.
- Tyson, T. 2013. L'expérience de diffusion de Rutherford. Récupéré de: 122.physics.ucdavis.edu.
- Xaktly. Expériences de Rutherford. Récupéré de: xaktly.com.
- Wikipédia. L'expérience de Rutherford. Récupéré de: es.wikipedia.org.



Personne n'a encore commenté ce post.