
Histoire du fluor, propriétés, structure, obtention, risques, utilisations
le fluor C'est un élément chimique qui est représenté par le symbole F et le groupe de têtes 17, auquel appartiennent les halogènes. Il se distingue au-dessus des autres éléments du tableau périodique, pour être le plus réactif et électronégatif; réagit avec presque tous les atomes, il forme donc d'innombrables sels et composés organofluorés.
Dans des conditions normales, il s'agit d'un gaz jaune pâle, qui peut être confondu avec le vert jaunâtre. À l'état liquide, illustré sur l'image ci-dessous, sa couleur jaune s'intensifie un peu plus, qui disparaît complètement lorsqu'elle se solidifie à son point de congélation..

Telle est sa réactivité, malgré le caractère volatil de son gaz, qu'il reste piégé dans la croûte terrestre; notamment sous la forme de la fluorite minérale, connue pour ses cristaux violets. De même, sa réactivité en fait une substance potentiellement dangereuse; réagit vigoureusement à tout ce qu'il touche et brûle dans les flammes.
Cependant, nombre de ses sous-produits peuvent être inoffensifs et même bénéfiques, selon leurs applications. Par exemple, l'utilisation la plus populaire du fluorure, ajouté sous sa forme ionique ou minérale (comme les sels de fluorure), est la préparation de dentifrices au fluor, qui aident à protéger l'émail des dents..
Le fluor a la particularité de pouvoir stabiliser les nombres élevés ou les états d'oxydation de nombreux autres éléments. Plus le nombre d'atomes de fluor est élevé, plus le composé est réactif (sauf s'il s'agit d'un polymère). De même, ses effets avec les matrices moléculaires augmenteront; pour le meilleur ou pour le pire.
Index des articles
- 1 Histoire
- 1.1 Utilisation de la fluorite
- 1.2 Préparation de l'acide fluorhydrique
- 1.3 Isolation
- 1.4 Intérêt pour le fluorure
- 2 Propriétés physiques et chimiques
- 2.1 Apparence
- 2.2 Numéro atomique (Z)
- 2.3 Poids atomique
- 2.4 Point de fusion
- 2.5 Point d'ébullition
- 2.6 Densité
- 2.7 Chaleur de vaporisation
- 2,8 Capacité thermique molaire
- 2.9 Pression de vapeur
- 2.10 Conductivité thermique
- 2.11 Ordre magnétique
- 2.12 Odeur
- 2.13 nombres d'oxydation
- 2.14 Énergie d'ionisation
- 2.15 Electronégativité
- 2.16 Agent oxydant
- 2.17 Réactivité
- 3 Structure et configuration électronique
- 3.1 Molécule diatomique
- 3.2 Liquide et solide
- 4 Où trouver et obtenir
- 4.1 Traitement de la fluorite
- 4.2 Electrolyse du fluorure d'hydrogène
- 5 isotopes
- 6 Rôle biologique
- 7 risques
- 7.1 Fluorose dentaire
- 7.2 Fluorose squelettique
- 8 utilisations
- 8.1 Dentifrices
- 8.2 Fluoration de l'eau
- 8.3 Agent oxydant
- 8.4 Polymères
- 8.5 Pharmaciens
- 8.6 Gravure sur verre
- 8.7 Enrichissement de l'uranium
- 9 Références
Histoire
Utilisation de fluorite
En 1530, le minéralogiste allemand Georgius Agricola découvrit que le spath fluor minéral pouvait être utilisé dans la purification des métaux. Le spath fluor est un autre nom pour la fluorite, un minéral de fluor composé de fluorure de calcium (CaFdeux).
L'élément fluor n'avait pas été découvert à ce moment-là et le "fluoir" dans la fluorite venait du mot latin "fluere" qui signifie "couler"; puisque c'était précisément ce que faisaient le spath fluor ou la fluorite avec les métaux: cela les aidait à sortir de l'échantillon.
Préparation d'acide fluorhydrique
En 1764, Andreas Sigismud Margraff réussit à préparer de l'acide fluorhydrique en chauffant la fluorite avec de l'acide sulfurique. Les cornues de verre ont été fondues par l'action de l'acide, le verre a donc été remplacé par des métaux.
Il est également attribué à Carl Scheele en 1771, la préparation de l'acide par la même méthode suivie par Margraff. En 1809, le scientifique français André-Marie Ampère a proposé que l'acide fluorique ou fluorhydrique était un composé composé d'hydrogène et d'un nouvel élément similaire au chlore..
Les scientifiques ont essayé d'isoler le fluorure en utilisant de l'acide fluorhydrique pendant une longue période; mais sa dangerosité rendait les progrès en ce sens difficiles.
Humphry Davy, Joseph Louis Gay-Lussac et Jacques Thénard ont eu de fortes douleurs lorsqu'ils ont inhalé du fluorure d'hydrogène (acide fluorhydrique sans eau et sous forme gazeuse). Les scientifiques Paulin Louyet et Jerome Nickles sont morts d'un empoisonnement dans des circonstances similaires.
Edmond Frémy, un chercheur français, a tenté de créer de l'acide fluorhydrique sec pour éviter la toxicité du fluorure d'hydrogène en acidifiant le bifluorure de potassium (KHFdeux), mais pendant l'électrolyse il n'y avait pas de conduction du courant électrique.
Isolation
En 1860, le chimiste anglais George Gore a tenté l'électrolyse de l'acide fluorhydrique sec et a réussi à isoler une petite quantité de fluor gazeux. Cependant, une explosion s'est produite lorsque l'hydrogène et le fluor se sont violemment recombinés. Gore a attribué l'explosion à une fuite d'oxygène..
En 1886, le chimiste français Henri Moisson réussit à isoler le fluor pour la première fois. Auparavant, le travail de Moisson était interrompu quatre fois par une grave intoxication au fluorure d'hydrogène, alors qu'il tentait d'isoler l'élément..
Moisson était un élève de Frémy et s'est appuyé sur ses expériences pour isoler le fluor. Moisson a utilisé un mélange de fluorure de potassium et d'acide fluorhydrique dans l'électrolyse. La solution résultante conduit l'électricité et le fluor gazeux collectés à l'anode; c'est-à-dire à l'électrode chargée positivement.
Moisson a utilisé un équipement résistant à la corrosion, dans lequel les électrodes étaient constituées d'un alliage de platine et d'iridium. Lors de l'électrolyse, il a utilisé un récipient en platine et refroidi la solution d'électrolyte à une température de -23 ° F (-31 ° C)..
Enfin, le 26 juin 1886, Henri Moissson réussit à isoler le fluor, travail qui lui permit de remporter le prix Nobel en 1906.
Intérêt pour le fluor
L'intérêt pour la recherche sur le fluorure a été perdu pendant un certain temps. Cependant, le développement du projet Manhattan pour la production de la bombe atomique, l'a à nouveau boosté.
La société américaine Dupont a développé, entre les années 1930 et 1940, des produits fluorés tels que les chlorofluorocarbures (Fréon-12), utilisés comme réfrigérants; et le plastique polytétrafluoroéthylène, mieux connu sous le nom de Téflon. Cela a entraîné une augmentation de la production et de la consommation de fluorure..
En 1986, lors d'une conférence d'environ un siècle après l'isolement du fluor, le chimiste américain Karl O. Christe a présenté une méthode chimique pour la préparation du fluor par la réaction entre KdeuxMnF6 et le SbF5.
Proprietes physiques et chimiques
Apparence
Le fluor est un gaz jaune pâle. À l'état liquide, il est jaune vif. Pendant ce temps, le solide peut être opaque (alpha) ou transparent (bêta).
Numéro atomique (Z)
9.
Poids atomique
18 998 unités.
Point de fusion
-219,67 ºC.
Point d'ébullition
-188,11 ºC.
Densité
À température ambiante: 1,696 g / L.
Au point de fusion (liquide): 1,505 g / mL.
Chaleur de vaporisation
6,51 kJ / mol.
Capacité thermique molaire
31 J / (mol K).
La pression de vapeur
À une température de 58 K, il a une pression de vapeur de 986,92 atm.
Conductivité thermique
0,0277 W / (m K)
Ordre magnétique
Diamagnétique
Odeur
Odeur caractéristique piquante et piquante, détectable même à 20 ppb.
Numéros d'oxydation
-1, qui correspond à l'anion fluorure, F-.
Énergie d'ionisation
-Premièrement: 1681 kJ / mol
-Deuxième: 3374 kJ / mol
-Troisième: 6 147 KJ / mol
Électronégativité
3.98 sur l'échelle de Pauling.
C'est l'élément chimique avec les électronégativités les plus élevées; c'est-à-dire qu'il a une forte affinité pour les électrons des atomes avec lesquels il se lie. Pour cette raison, les atomes de fluor génèrent de grands moments dipolaires dans des régions spécifiques d'une molécule..
Son électronégativité a également un autre effet: les atomes qui lui sont liés perdent tellement de densité électronique qu'ils commencent à acquérir une charge positive; c'est, un nombre d'oxydation positif. Plus il y a d'atomes de fluor dans un composé, l'atome central aura un indice d'oxydation plus positif..
Par exemple, dans l'OFdeux l'oxygène a un indice d'oxydation de +2 (Odeux+Fdeux-); dans l'UF6, L'uranium a un indice d'oxydation de +6 (U6+F6-); la même chose se produit avec le soufre dans SF6 (S6+F6-); et enfin il y a l'AgFdeux, où l'argent a même un indice d'oxydation de +2, rare pour lui.
Par conséquent, les éléments parviennent à participer avec leurs indices d'oxydation les plus positifs lorsqu'ils forment des composés avec du fluor..
Agent d'oxydation
Le fluor est l'élément oxydant le plus puissant, donc aucune substance n'est capable de l'oxyder; et pour cette raison, il n'est pas trouvé libre dans la nature.
Réactivité
Le fluor est capable de se combiner avec tous les autres éléments à l'exception de l'hélium, du néon et de l'argon. Il n'attaque pas non plus l'acier doux ou le cuivre à des températures normales. Réagit violemment avec les matières organiques telles que le caoutchouc, le bois et le tissu.
Le fluor peut réagir avec le xénon de gaz rare pour former le difluorure de xénon oxydant fort, XeFdeux. Il réagit également avec l'hydrogène pour former un halogénure, du fluorure d'hydrogène, HF. À son tour, le fluorure d'hydrogène se dissout dans l'eau pour produire le célèbre acide fluorhydrique (sous forme de verre).
L'acidité des acides acides, classée par ordre croissant, est:
HF < HCl < HBr < HI
L'acide nitrique réagit avec le fluor pour former du nitrate de fluor, FNO3. Pendant ce temps, l'acide chlorhydrique réagit vigoureusement avec le fluor pour former HF, OFdeux et ClF3.
Structure et configuration électronique

Molécule diatomique

L'atome de fluor dans son état fondamental a sept électrons de valence, qui sont dans les orbitales 2s et 2p selon la configuration électronique:
[He] 2sdeux 2 P5
La théorie de la liaison de valence (VTE) stipule que deux atomes de fluor, F, sont liés de manière covalente à chacun complète son octet de valence.
Cela se produit rapidement car il suffit d'un seul électron pour devenir isoélectronique par rapport au gaz rare néon; et ses atomes sont très petits, avec une charge nucléaire efficace très forte qui exige facilement des électrons de l'environnement.
La molécule Fdeux (image du haut), a une seule liaison covalente, F-F. Malgré sa stabilité par rapport aux atomes de F libres, c'est une molécule hautement réactive; homonucléaire, apolaire et avide d'électrons. C'est pourquoi le fluor, comme Fdeux, c'est une espèce très toxique et dangereuse.
Parce que le Fdeux est apolaire, ses interactions dépendent de sa masse moléculaire et des forces de diffusion de Londres. À un moment donné, le nuage électronique autour des deux atomes F doit se déformer et créer un dipôle instantané qui en induit un autre dans une molécule voisine; pour qu'ils s'attirent lentement et faiblement.
Liquide et solide
La molécule Fdeux il est très petit et se diffuse assez rapidement dans l'espace. Dans sa phase gazeuse, il présente une couleur jaune pâle (qui peut être confondue avec un vert citron). Lorsque la température descend à -188 ºC, les forces de dispersion deviennent plus efficaces et rendent les molécules Fdeux fusionner suffisamment pour définir un liquide.
Le fluor liquide (première image) semble encore plus jaune que son gaz respectif. Dans celui-ci, les molécules Fdeux ils sont plus proches et interagissent davantage avec la lumière. Fait intéressant, une fois que le cristal de fluor cubique déformé se forme à -220 ° C, la couleur s'estompe et reste sous forme d'un solide transparent..
Maintenant que les molécules Fdeux sont si proches (mais sans que leurs rotations moléculaires s'arrêtent), il semble que leurs électrons acquièrent une certaine stabilité et, par conséquent, leur saut électronique est trop important pour que la lumière interagisse même avec le cristal.
Phases cristallines
Ce cristal cubique correspond à la phase β (ce n'est pas un allotrope car c'est toujours le même Fdeux). Lorsque la température baisse encore plus, jusqu'à -228 ºC, le fluor solide subit une transition de phase; le cristal cubique devient monoclinique, la phase α:
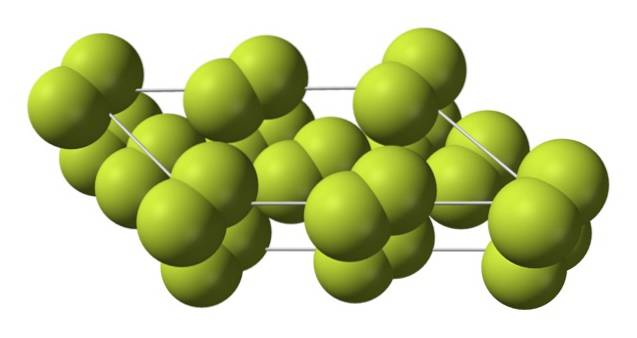
Contrairement à β-Fdeux, le α-Fdeux il est opaque et dur. C'est peut-être parce que les molécules Fdeux ils n'ont plus autant de liberté de rotation dans leurs positions fixes sur des cristaux monocliniques; où ils interagissent davantage avec la lumière, mais sans exciter leurs électrons (ce qui expliquerait superficiellement leur opacité).
La structure cristalline de α-Fdeux il a été difficile à étudier par les méthodes classiques de diffraction des rayons X. En effet, le passage de la phase β à la phase α est très exothermique; donc le cristal a pratiquement explosé, en même temps qu'il avait peu d'interaction avec le rayonnement.
Il a fallu environ cinquante ans avant que des scientifiques allemands (Florian Kraus et al.) Déchiffrent complètement la structure de α-Fdeux plus précisément grâce aux techniques de diffraction neutronique.
Où trouver et obtenir
Le fluor se classe 24e parmi les éléments les plus courants de l'univers. Cependant, sur Terre, c'est la masse 13vo élément, avec une concentration de 950 ppm dans la croûte terrestre et une concentration de 1,3 ppm dans l'eau de mer.
Les sols ont une concentration de fluorure comprise entre 150 et 400 ppm, et dans certains sols, la concentration peut atteindre 1 000 ppm. Dans l'air atmosphérique, il est présent à une concentration de 0,6 ppb; mais il a été enregistré dans certaines villes jusqu'à 50 ppb.
Le fluor est obtenu principalement à partir de trois minéraux: la fluorite ou le fluorospar (CaFdeux), fluoroapatite [Ca5(PO4)3F] et cryolite (Na3AlF6).
Traitement de la fluorite
Après avoir collecté les roches avec la fluorite minérale, elles sont soumises à un concassage primaire et secondaire. Avec le concassage secondaire, de très petits fragments de roche sont obtenus.
Les fragments de roche sont ensuite transportés dans un broyeur à boulets pour être réduits en poudre. De l'eau et des réactifs sont ajoutés pour former une pâte, qui est placée dans un réservoir de flottation. L'air est injecté sous pression pour former des bulles, et ainsi la fluorite finit par flotter sur la surface aqueuse.
Les silicates et les carbonates se déposent tandis que la fluorite est collectée et transportée dans des fours de séchage..
Une fois le fluorite obtenu, il est mis à réagir avec de l'acide sulfurique pour produire du fluorure d'hydrogène:
CaFdeux + HdeuxSW4 => 2 HF + CaSO4
Electrolyse du fluorure d'hydrogène
Dans la production de fluor, la méthode utilisée par Moisson en 1886 est suivie, avec quelques modifications..
Une électrolyse est faite d'un mélange de fluorure de potassium fondu et d'acide fluorhydrique, avec un rapport molaire de 1: 2,0 à 1: 2,2. La température du sel fondu est de 70 à 130 ºC.
La cathode est constituée d'un alliage ou d'un acier Monel et l'anode est en dégraphite de carbone. Le processus de production de fluor pendant l'électrolyse peut être décrit comme suit:
2HF => Hdeux + Fdeux
L'eau est utilisée pour refroidir la chambre d'électrolyse, mais la température doit être supérieure au point de fusion de l'électrolyte pour éviter la solidification. L'hydrogène produit par électrolyse est collecté à la cathode, tandis que le fluor à l'anode.
Les isotopes
Le fluor a 18 isotopes, étant le 19F le seul isotope stable avec une abondance de 100%. le 18F a une demi-vie de 109,77 minutes et est l'isotope radioactif du fluor avec la demi-vie la plus longue. le 18F est utilisé comme source de positrons.
Rôle biologique
Il n'y a pas d'activité métabolique connue du fluor chez les mammifères ou les plantes supérieures. Cependant, certaines plantes et éponges marines synthétisent le monofluoroacétate, un composé toxique, qu'elles utilisent comme protection pour empêcher sa destruction..
Des risques
Une consommation excessive de fluorure a été associée à une fluorose osseuse chez les adultes et à une fluorose dentaire chez les enfants, ainsi qu'à des altérations de la fonction rénale. Pour cette raison, le Service de santé publique des États-Unis (PHS) a suggéré que la concentration de fluorure dans l'eau potable ne devrait pas être supérieure à 0,7 mg / L.
Pendant ce temps, l'Agence américaine de protection de l'environnement (EPA) a établi que la concentration de fluorure dans l'eau potable ne devrait pas être supérieure à 4 mg / L, afin d'éviter la fluorose squelettique, dans laquelle le fluorure s'accumule dans les os. Cela peut entraîner un affaiblissement de l'os et des fractures..
Le fluor a été associé à des lésions de la glande parathyroïde, avec une diminution du calcium dans les structures osseuses et des concentrations élevées de calcium dans le plasma.
Parmi les altérations attribuées à un excès de fluor, on peut citer: la fluorose dentaire, la fluorose squelettique et les lésions de la glande parathyroïde.
Fluorose dentaire
La fluorose dentaire se produit avec de petites stries ou des taches dans l'émail des dents. Les enfants de moins de 6 ans ne doivent pas utiliser de rince-bouche contenant du fluor..
Fluorose squelettique
Dans la fluorose squelettique, la douleur et les dommages aux os, ainsi qu'aux articulations, peuvent être diagnostiqués. L'os peut durcir et perdre de son élasticité, augmentant le risque de fractures.
Applications
Dentifrice

Nous commençons par la section sur les utilisations du fluor avec la plus connue: celle de servir comme composant de nombreux dentifrices. Ce n'est pas la seule utilisation où le contraste entre sa molécule F est appréciédeux, extrêmement toxique et dangereux, et l'anion F-, ce qui en fonction de votre environnement peut être bénéfique (bien que parfois non).
Lorsque nous mangeons des aliments, en particulier des sucreries, les bactéries les décomposent en augmentant l'acidité de notre salive. Puis vient un point où le pH est suffisamment acide pour dégrader et déminéraliser l'émail des dents; l'hydroxyapatite se décompose.
Cependant, dans ce processus, les ions F- interagir avec Cadeux+ pour former une matrice de fluorapatite; plus stable et durable que l'hydroxyapatite. Ou du moins, c'est le mécanisme proposé pour expliquer l'action de l'anion fluorure sur les dents. Il est susceptible d'être plus complexe et d'avoir un équilibre hydroxyapatite-fluorapatite dépendant du pH.
Ces anions F- Ils sont disponibles dans les usines dentaires sous forme de sels; tels que: NaF, SnFdeux (le fameux fluorure stanneux) et NaPOF. Cependant, la concentration de F- Il doit être faible (moins de 0,2%), car sinon il provoque des effets négatifs sur le corps.
Fluoration de l'eau
Tout comme le dentifrice, des sels de fluor ont été ajoutés aux sources d'eau potable pour lutter contre les caries chez ceux qui en boivent. La concentration doit encore être beaucoup plus faible (0,7 ppm). Cependant, cette pratique fait souvent l'objet de méfiance et de controverse, car on lui a attribué d'éventuels effets cancérigènes..
Agent d'oxydation
Gaz Fdeux il se comporte comme un oxydant très puissant. Cela fait brûler de nombreux composés plus rapidement que lorsqu'ils sont exposés à l'oxygène et à une source de chaleur. C'est pourquoi il a été utilisé dans des mélanges de carburants pour fusées, dans lesquels il peut même remplacer l'ozone.
Polymères
Dans de nombreuses utilisations, les contributions du fluor ne sont pas dues à la Fdeux ou F-, mais directement à ses atomes électronégatifs en tant que partie d'un composé organique. En substance, nous parlons d'un lien C-F..
Selon la structure, les polymères ou les fibres avec des liaisons C-F sont généralement hydrophobes, ils ne se mouillent donc pas ou ne résistent pas à l'attaque de l'acide fluorhydrique; Ou mieux encore, ils peuvent être d'excellents isolants électriques et des matériaux utiles à partir desquels des objets tels que des tuyaux et des joints sont fabriqués. Le téflon et le nafion sont des exemples de ces polymères fluorés.
Pharmaciens
La réactivité du fluor rend son utilisation pour la synthèse de multiples composés fluorés, organiques ou inorganiques, discutable. Dans les matières organiques, en particulier celles ayant des effets pharmacologiques, le remplacement d'un de leurs hétéroatomes par des atomes F augmente (positivement ou négativement) leur action sur leur cible biologique..
C'est pourquoi, dans l'industrie pharmaceutique, la modification de certains médicaments en ajoutant des atomes de fluor est toujours sur la table..
La même chose se produit avec les herbicides et les fongicides. Le fluorure qu'ils contiennent peut augmenter leur action et leur efficacité sur les insectes et les champignons nuisibles..
Gravure sur verre
L'acide fluorhydrique, en raison de son agressivité avec le verre et la céramique, a été utilisé pour graver des pièces minces et délicates de ces matériaux; généralement destinés à la fabrication de microcomposants d'ordinateurs, ou d'ampoules électriques.
L'enrichissement d'uranium
L'une des utilisations les plus pertinentes du fluor élémentaire est d'aider à enrichir l'uranium en tant que 235U. Pour cela, les minéraux d'uranium sont dissous dans l'acide fluorhydrique, produisant de l'UF4. Ce fluorure inorganique réagit alors avec le Fdeux, se transformer ainsi en UF6 (235PHEW6 Oui 238PHEW6).
Par la suite, et par centrifugation gazeuse, le 235PHEW6 se sépare de 238PHEW6 pour être ensuite oxydé et stocké comme combustible nucléaire.
Les références
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Krämer Katrina. (2019). La structure du fluor congelé revisitée après 50 ans. La Société royale de chimie. Récupéré de: chemistryworld.com
- Wikipédia. (2019). Fluor. Récupéré de: en.wikipedia.org
- Centre national d'information sur la biotechnologie. (2019). Fluor. Base de données PubChem. CID = 24524. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Dr Doug Stewart. (2019). Faits sur les éléments fluorés. Chemicool. Récupéré de: chemicool.com
- Batul Nafisa Baxamusa. (2018, 21 février). Les utilisations étonnamment courantes du fluor hautement réactif. Récupéré de: sciencestruck.com
- Paola Opazo Sáez. (04 février 2019). Le fluor dans le dentifrice: est-il bon ou mauvais pour votre santé? Récupéré de: nacionfarma.com
- Karl Christe et Stefan Schneider. (08 mai 2019). Fluor: élément chimique. Encyclopædia Britannica. Récupéré de: britannica.com
- Lenntech B.V. (2019). Tableau périodique: oxygène. Récupéré de: lenntech.com
- Gagnon Steve. (s.f.). L'élément fluor. Jefferson Lab. Récupéré de: education.jlab.org
- L'équipe de contenu médical et éditorial de l'American Cancer Society. (2015, 28 juillet). Fluoration de l'eau et risque de cancer. Récupéré de: cancer.org



Personne n'a encore commenté ce post.