
Structure, propriétés, production, utilisations du phosphate d'aluminium (AlPO4)

le phosphate d'aluminium est un solide inorganique formé par un ion aluminium Al3+ et un ion phosphate PO43-. Sa formule chimique est AlPO4. C'est un solide blanc dont la structure cristalline est similaire à celle de la silice SiOdeux. Il est insoluble dans l'eau.
Il peut être obtenu à partir d'alumine (AldeuxOU ALORS3) et l'acide phosphorique (H3PO4). Il peut également être obtenu à partir de solutions aqueuses de chlorure d'aluminium (AlCl3) et phosphate de sodium (Na3PO4).

Le phosphate d'aluminium a un point de fusion très élevé, c'est pourquoi il est largement utilisé comme composant des céramiques réfractaires, c'est-à-dire des céramiques qui résistent à des températures très élevées..
Il est également utilisé comme antiacide pour l'estomac, dans des mélanges pour la réparation des dents et comme adjuvant aux vaccins, c'est-à-dire pour stimuler la réponse immunitaire de l'organisme..
Certains bétons réfractaires ont AlPO4 dans sa composition, ce qui augmente les propriétés mécaniques et de support à haute température de ce type de ciment.
Il a été utilisé comme écran protecteur pour empêcher les matériaux combustibles tels que certains polymères de brûler.
Index des articles
- 1 Structure
- 2 Nomenclature
- 3 propriétés
- 3.1 État physique
- 3.2 Poids moléculaire
- 3.3 Point de fusion
- 3.4 Densité
- 3.5 Solubilité
- 3.6 Autres propriétés
- 4 Obtention
- 5 Utilisation dans la céramique
- 5.1 Fabrication de céramiques au phosphate d'aluminium
- 6 Autres utilisations
- 6.1 Pour obtenir du béton
- 6.2 Dans les ciments dentaires
- 6.3 Dans les vaccins
- 6.4 En tant qu'ignifuge dans les polymères
- 7 Références
Structure
L'AlPO4 Il est formé par un cation aluminium Al3+ et un anion phosphate PO43-.
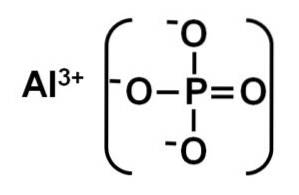
Le phosphate d'aluminium cristallin est également appelé berlinite ou phase alpha (α-AlPO4) et ses cristaux sont similaires au quartz.

La phase alpha du phosphate d'aluminium est un solide formé par un réseau covalent de tétraèdres PO4 et AlPO4 qui alternent et sont liés par des atomes d'oxygène.
Cette structure est isomorphe à la silice, c'est-à-dire qu'elle a la même forme que celle de la silice SiOdeux.
Nomenclature
- Phosphate d'aluminium
- Monophosphate d'aluminium
- Sel d'aluminium d'acide phosphorique.
Propriétés
État physique
Cristallin blanc solide.
Poids moléculaire
121,93 g / mol
Point de fusion
1 800 ºC
Densité
2,56 g / cm3
Solubilité
Insoluble dans l'eau
Autres propriétés
La structure de l'AlPO4 est très similaire à la silice SiOdeux, il partage donc de nombreuses propriétés physiques et chimiques de ce.
Le phosphate d'aluminium est un matériau hautement réfractaire, c'est-à-dire qu'il résiste à des températures très élevées sans changer son état physique ou sa structure et sans se décomposer.
L'AlPO4 cristalline ou berlinite lorsqu'elle est chauffée se transforme en une structure de type tridymite, puis de type cristobalite, autres formes de ce composé qui ressemblent à la silice SiOdeux.

Obtention
Phosphate d'aluminium AlPO4 peut être obtenu par réaction entre l'acide phosphorique H3PO4 et alumine AldeuxOU ALORS3. Une application de température est requise, par exemple entre 100 et 150 ° C.
AudeuxOU ALORS3 + 2 heures3PO4 = 2 AlPO4 + 3 HdeuxOU ALORS
Il peut également être obtenu en joignant une solution aqueuse de chlorure d'aluminium AlCl3 avec une solution aqueuse de phosphate de sodium Na3PO4:
AlCl3 + N / A3PO4 = AlPO4 + 3 NaCl
Utilisation dans la céramique
Phosphate d'aluminium AlPO4 se retrouve souvent dans la constitution des céramiques d'alumine.
La céramique à haute teneur en alumine est l'un des matériaux qui, en raison de sa dureté, est utilisé dans des applications où il est nécessaire de résister à des charges élevées et à des conditions sévères..
Ce type de céramique résiste à la corrosion, aux environnements à haute température, à la présence de vapeur chaude ou aux atmosphères réductrices comme le monoxyde de carbone (CO)..
La céramique d'alumine a également une faible conductivité électrique et thermique, c'est pourquoi elle est utilisée pour fabriquer des briques réfractaires et des composants électriquement isolants..

Parce que le phosphate d'aluminium se forme à une température beaucoup plus basse que la silice SiOdeux, sa production est moins chère, ce qui constitue un avantage dans la fabrication de céramiques adaptées aux services exigeants.
Fabrication de céramique de phosphate d'aluminium
L'alumine est utiliséedeuxOU ALORS3 et acide phosphorique H3PO4 en milieu aqueux.
Le pH de formation préféré est de 2 à 8, car il existe une abondance d'espèces d'acide phosphorique dissoutes, telles que HdeuxPO4- et HPO4deux-. À pH acide, la concentration d'ions Al3+ est élevé, provenant de la dissolution de l'alumine AldeuxOU ALORS3.
Tout d'abord, un gel de trihydrogène diphosphate d'aluminium hydraté AlH est formé.3(PO4)deux.HdeuxOU ALORS:
Au3+ + HdeuxPO4- + HPO4deux- + HdeuxO ⇔ AlH3(PO4)3.HdeuxOU ALORS
Cependant, il arrive un moment où le pH de la solution baisse et devient neutre, où l'alumine AldeuxOU ALORS3 il a une faible solubilité. A ce moment, l'alumine insoluble forme une couche à la surface des particules, empêchant la réaction de se poursuivre..
Par conséquent, il est nécessaire d'augmenter la solubilité de l'alumine et ceci est obtenu en chauffant doucement. En chauffant à 150 ° C, le gel poursuit la réaction avec l'alumine AldeuxOU ALORS3 libérant de l'eau et de la berlinite cristalline (alpha-AlPO4).
AudeuxOU ALORS3 + 2 AlH3(PO4)3.HdeuxO → AlPO4 + 4 heuresdeuxOU ALORS
La berlinite lie les particules individuelles et forme la céramique.
Autres utilisations
L'AlPO4 Il est utilisé comme antiacide, comme adsorbant, comme tamis moléculaire, comme support de catalyseur et comme revêtement pour améliorer la résistance à la corrosion à chaud. Ci-dessous d'autres applications.
En obtenant du béton
Le phosphate d'aluminium est un ingrédient des bétons réfractaires ou des bétons résistants à la chaleur.
Il confère à ces bétons d'excellentes propriétés mécaniques et réfractives, comme la résistance à la chaleur. Dans la plage de température comprise entre 1400 et 1600 ° C, le béton cellulaire à base de phosphate d'aluminium est l'un des matériaux les plus efficaces en tant qu'isolant thermique..
Il ne nécessite pas de séchage, son durcissement est obtenu par une réaction exothermique auto-propagée. Il est possible de préparer des briques de ce matériau de toute forme et taille.
Dans les ciments dentaires
Le phosphate d'aluminium fait partie des ciments dentaires ou des matériaux utilisés pour guérir les dents cariées.
Dans les ciments dentaires, l'alumine est utilisée comme modérateur des réactions acide-base, où l'effet modérateur est dû à la formation de phosphate d'aluminium sur les particules d'autres matériaux..
Ces ciments ont une très haute résistance à la compression et à la traction, qui est due à la présence de phosphate d'aluminium.
Dans les vaccins
L'AlPO4 Il est utilisé depuis de nombreuses années dans divers vaccins humains pour améliorer la réponse immunitaire du corps. On dit que l'AlPO4 c'est un "adjuvant" aux vaccins. Le mécanisme n'est toujours pas bien compris.
On sait que l'effet immunostimulant de l'AlPO4 cela dépend du processus d'adsorption de l'antigène sur l'adjuvant, c'est-à-dire de la manière dont il y adhère. Un antigène est un composé qui, en entrant dans le corps, génère la formation d'anticorps pour combattre une maladie spécifique.
Les antigènes peuvent être adsorbés sur AlPO4 par interactions électrostatiques ou par liaison avec des ligands. Ils sont adsorbés à la surface de l'adjuvant.
On pense en outre que la taille des particules d'AlPO4 il a également une influence. Plus la taille des particules est petite, plus la réponse des anticorps est plus importante et plus durable..
En tant qu'ignifuge dans les polymères
L'AlPO4 Il a été utilisé comme ignifuge et pour empêcher la combustion ou la combustion de certains polymères.
L'ajout d'AlPO4 à un polymère de polypropylène qui a déjà un retardateur de flamme provoque un effet synergique entre les deux retardateurs, ce qui signifie que l'effet est beaucoup plus grand que celui des deux retardateurs de feu séparément.
Lorsque le polymère est soumis à la combustion ou brûlé en présence d'AlPO4, il se forme un métaphosphate d'aluminium qui pénètre dans la surface carbonisée et remplit les pores et les fissures de ce.
Cela conduit à la formation d'un écran protecteur hautement efficace pour empêcher la combustion ou la combustion du polymère. En d'autres termes, l'AlPO4 scelle la surface carbonisée et empêche le polymère de brûler.

Les références
- Abyzov, V.A. (2016). Béton réfractaire léger à base de liant aluminium-magnésium-phosphate. Procedia Engineering 150 (2016) 1440-1445. Récupéré de sciencedirect.com.
- Wagh, A.S. (2016). Céramiques au phosphate d'aluminium. Dans la céramique de phosphate chimiquement liée (deuxième édition). Chapitre 11. Récupéré de sciencedirect.com.
- Mei, C. et coll. (2019). Adjuvant de vaccin au phosphate d'aluminium: analyse de la composition et de la taille à l'aide d'outils hors ligne et en ligne. Comput Struct Biotechnol J. 2019; 17: 1184-1194. Récupéré de ncbi.nlm.nih.gov.
- Qin, Z. et coll. (2019). Effet de barrière synergique du phosphate d'aluminium sur le polypropylène ignifuge à base de système polyphosphate d'ammonium / dipentaérythritol. Matériaux et conception 181 (2019) 107913. Récupéré de sciencedirect.com.
- Vrieling, H. et coll. (2019). Nanoparticules de phosphate d'aluminium stabilisées utilisées comme adjuvant de vaccin. Colloïdes et surfaces B: Biointerfaces 181 (2019) 648-656. Récupéré de sciencedirect.com.
- Schaefer, C. (2007). Médicaments gastro-intestinaux. Les antiacides. Dans les médicaments pendant la grossesse et l'allaitement (deuxième édition). Récupéré de sciencedirect.com.
- .



Personne n'a encore commenté ce post.