
Formule minimale comment obtenir la formule minimale, des exemples et des exercices
La formule minimale ou empirique C'est une expression de la proportion dans laquelle les atomes des différents éléments qui composent un composé chimique sont présents. La formule minimale est donc la représentation la plus simple d'un composé chimique. C'est pourquoi c'est `` minimal ''.
La formule minimale n'exprime pas le nombre d'atomes des différents éléments qui composent un composé chimique; mais la proportion dans laquelle ces atomes se combinent pour générer le composé chimique.
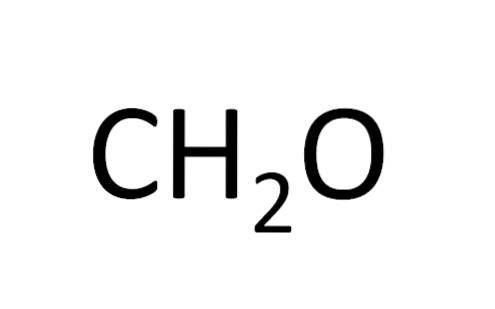
La formule minimale est également appelée formule empirique, puisqu'elle est obtenue par expérimentation; c'est-à-dire qu'il est lié à l'expérience. L'observation expérimentale a permis de conclure que deux atomes d'hydrogène se combinent avec un atome d'hydrogène pour former de l'eau (HdeuxOU ALORS).
Dans de nombreux cas, la formule minimale correspond à la formule moléculaire. Dans le moléculaire, les nombres réels des différents éléments qui composent un composé chimique apparaissent; c'est le cas par exemple de l'acide sulfurique (HdeuxSW4).
Mais dans d'autres cas, il n'y a pas de coïncidence entre la formule minimale et la formule moléculaire; Tel est le cas du benzène: la formule minimale est CH, tandis que sa formule moléculaire est C6H6.
Index des articles
- 1 Comment obtenir la formule minimale?
- 1.1 Première étape
- 1.2 Deuxième étape
- 1.3 Troisième étape
- 1.4 Quatrième étape
- 2 Exemples de formule minimum
- 2.1 Eau et dioxyde de carbone
- 2.2 Oxydes basiques et acides
- 2.3 Acide acétique
- 2.4 Acide butyrique
- 2.5 Éthylène glycol
- 2.6 Benzène
- 2.7 Glucose
- 3 exercices résolus
- 3.1 - Exercice 1
- 3.2 - Exercice 2
- 4 Références
Comment obtenir la formule minimale?
Premier pas
Trouvez les grammes de chaque élément présent dans le composé. Comme ils sont généralement exprimés en pourcentage de la masse du composé, un calcul simple doit être effectué pour la transformation des pourcentages massiques en masse des éléments.
Deuxième pas
Le nombre relatif d'atomes des différents éléments qui composent le composé chimique est obtenu. Pour ce faire, la masse de chaque élément, exprimée en grammes, est divisée par sa masse atomique.
Certains auteurs préfèrent appeler le nombre relatif d'atomes, comme le nombre de moles d'atomes des éléments qui font partie du composé chimique.
Troisième étape
Obtention de la proportion minimale, exprimée en nombres entiers, de chacun des atomes présents dans le composé chimique.
Pour trouver ces valeurs, divisez les nombres relatifs de chaque atome présent dans le composé par la valeur numérique relative minimale d'un atome dans le composé chimique..
Dans le cas où la valeur de la proportion minimale d'un atome n'est pas un nombre entier sans décimales, toutes les valeurs de la proportion minimale doivent être multipliées par un nombre; de manière à permettre à toutes les valeurs de la proportion minimale d'être des nombres entiers.
Par exemple, si la valeur de la proportion minimale d'un atome du composé chimique est de 2,5, multipliez toutes les personnes les valeurs de la proportion minimale de chacun des atomes présents fois 2. Ainsi, toutes les valeurs de la proportion minimale ne seront que des nombres entiers.
Quatrième étape
Écrivez la formule minimale du composé. Les valeurs de la proportion minimale pour les atomes des différents éléments seront placées en indices des symboles chimiques des éléments pour écrire la formule minimale.
Exemples de formules minimales
Eau et dioxyde de carbone
La plupart des composés chimiques ont des formules qui sont à la fois des formules minimales et moléculaires. Ainsi, la formule de l'eau (HdeuxO) est une formule minimale; mais c'est aussi une formule moléculaire. Il en va de même pour la formule du dioxyde de carbone (COdeux).
Oxydes basiques et acides
Les oxydes basiques et acides sont des composés chimiques qui ont des formules chimiques, à quelques exceptions près qui sont à la fois des formules minimales et moléculaires. La même situation se produit avec les hydroxydes et les acides, à l'exception de certains acides carboxyliques..
Acide acétique
Les acides carboxyliques qui ont un nombre pair d'atomes de carbone dans leur composition ont, séparément, une formule minimale et une formule moléculaire. L'acide acétique, par exemple, a une formule moléculaire (CdeuxH4OU ALORSdeux); mais il a aussi une formule minimale (CHdeuxOU ALORS).
Acide butyrique
L'acide butyrique a également une formule moléculaire (C4H8OU ALORSdeux) et une formule minimale (CdeuxH4OU ALORS).
Éthylène glycol
D'autres composés organiques ont les deux types de formules chimiques; c'est le cas de l'éthylène glycol, qui a une formule moléculaire (CdeuxH6OU ALORSdeux) et une formule minimale (CH3OU ALORS).
Benzène
Le benzène, un composé aromatique, a une formule moléculaire (C6H6) et une formule minimale (CH).
Glucose
Le glucose a une formule moléculaire (C6H12OU ALORS6) et une formule minimale (CHdeuxOU ALORS).
Exercices résolus
- Exercice 1
L'éthylène glycol est un composé utilisé comme antigel, il a un poids moléculaire de 62,1 g / mol et une composition en pourcentage massique comme suit:
C: 38%,
H: 9,7%
Soit: 51,16%.
Premier pas
Exprimez les pourcentages massiques des éléments dans leurs masses en grammes. Pour cela, le poids moléculaire de l'éthylène glycol est pris comme référence. Si c'est 62,1 grammes par mole, 38% de celui-ci est constitué de carbone. Et ainsi de suite avec les autres éléments:
Masse de carbone = 62,1 g (38/100)
= 23,6 g
Masse d'hydrogène = 62,1 g (9,7 / 100)
= 6,024 g
Masse d'oxygène = 62,1 g (51,16 / 100)
= 31,77 g
Deuxième pas
Calculez le nombre relatif de chaque atome présent (NRA) ou le nombre de moles de chaque atome. Pour ce faire, la masse de chaque élément chimique est divisée par sa masse atomique.
NRA (C) = 23,6 g / 12 g
= 1,97
Peut être arrondi à 2.
NRA (H) = 6,024 g / 1 g
= 6,024
Peut être arrondi à 6.
NRA (O) = 31,77 g / 16 g
= 1 985
Peut être arrondi à 2.
Troisième étape
Calculez le rapport entier minimum des éléments du composé (PMNE). Pour ce faire, divisez chacune des valeurs des nombres relatifs atomiques (NRA) par la plus petite valeur de celui-ci. Dans ce cas, 2.
PMNE (C) = 2/2
= 1
PMNE (H) = 6/2
= 3
PMNE (O) = 2/2
= 1
Quatrième étape
Écrivez la formule minimale de l'éthylène glycol:
CH3OU ALORS
Comme on peut le voir, les valeurs obtenues à l'étape 3 sont les indices des éléments du composé.
- Exercice 2
L'acide acétique a un poids moléculaire de 60 g / mol et la composition en pourcentage massique suivante:
C: 40%
H: 6,67%
Soit: 53,33%
Obtenir la formule minimale du composé.
Premier pas
Transformez les pourcentages massiques des éléments en leurs masses exprimées en grammes:
Masse de carbone = 60 g (40/100)
= 24 g
Masse d'hydrogène = 60 g (6,67 / 100)
= 4 g
Masse d'oxygène = 60 g (53,33 / 100)
= 32 g
Deuxième pas
Calculez le nombre relatif d'atomes (NRA) du composé. Pour ce faire, les masses des éléments sont divisées par leurs masses atomiques:
NRA (C) = 24 g / 12 g
= 2
NRA (H) = 4 g / 1 g
= 4
NRA (O) = 32 g / 16 g
= 2
Troisième étape
Obtenir le rapport minimal des nombres entiers des éléments du composé (PMNE). Pour ce faire, les valeurs NRA des éléments sont divisées par la valeur NRA la plus basse d'un élément:
PMNE (C) = 2/2
= 1
PMNE (H) = 4/2
= 2
PMNE (O) = 2/2
= 1
Quatrième étape
Écrivez la formule minimale pour l'acide acétique:
CHdeuxOU ALORS
Les indices du composé sont les valeurs obtenues à partir du PMNE.
Les références
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE.
- Helmenstine, Anne Marie, Ph.D. (27 août 2019). Formule empirique: définition et exemples. Récupéré de: thinkco.com
- Wikipédia. (2020). Formule empirique. Récupéré de: en.wikipedia.org
- Chimie LibreTexts. (03 juillet 2019). Calcul des formules empiriques pour les composés. Récupéré de: chem.libretexts.org
- Nicola McDougal. (2020). Formule empirique: définition, étapes et exemples. Étude. Récupéré de: study.com



Personne n'a encore commenté ce post.