
Formule moléculaire comment l'obtenir, exemples et exercices
La formule moléculaire C'est une représentation d'une molécule d'un composé, dans laquelle les atomes de tous les éléments présents dans le composé et leur nombre sont indiqués par leurs symboles chimiques. Chaque atome est accompagné d'un indice.
La formule moléculaire a la limitation qu'elle n'indique pas les liaisons des différents atomes de la molécule, ni leur relation spatiale; comme le fait la formule développée. Dans certains cas, ce n'est pas spécifique, par exemple: C6H12OU ALORS6 est la formule moléculaire du glucose, du galactose et du fructose.
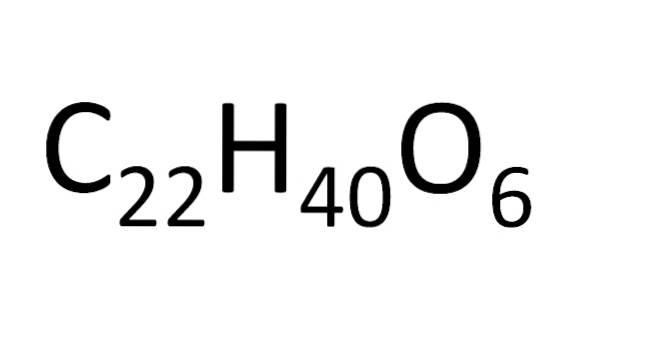
Il existe un ensemble de règles pour la disposition des atomes dans une formule moléculaire. Pour les sels ioniques, par exemple le chlorure de sodium, le symbole cationique (Na+) puis le symbole anionique (Cl-). C'est pourquoi la formule moléculaire du chlorure de sodium est NaCl.
La formule moléculaire des composés organiques est écrite en plaçant d'abord le symbole du carbone (C), suivi du symbole de l'hydrogène (H), puis des atomes restants. Par exemple, la formule moléculaire de l'acide acétique est CdeuxH4OU ALORSdeux.
Index des articles
- 1 Comment obtenir la formule moléculaire
- 1.1 Première étape
- 1.2 Deuxième étape
- 1.3 Troisième étape
- 1.4 Quatrième étape
- 1.5 Cinquième étape
- 2 Exemples de formules moléculaires
- 3 exercices résolus
- 3.1 - Exercice 1
- 3.2 - Exercice 2
- 4 Références
Comment obtenir la formule moléculaire
L'obtention de la formule moléculaire d'un composé est basée sur l'établissement préalable de sa formule minimale ou empirique. Pour cette raison, les étapes initiales d'obtention des deux formules sont courantes..
Premier pas
Il est courant d'exprimer la masse des éléments d'un composé chimique sous forme de pourcentage. Un simple calcul doit alors être effectué pour transformer les pourcentages massiques des différents éléments en leurs masses exprimées en grammes..
Deuxième pas
Connaissant la masse en gramme de chacun des éléments, et leur masse atomique, le nombre relatif de chaque atome ou le nombre de moles de chaque atome peut être obtenu en divisant la masse de chacun des différents éléments par leur masse atomique..
Troisième étape
Divisez les nombres relatifs de toutes les personnes les atomes, entrez le nombre relatif de plus petite valeur. Les valeurs de la proportion minimale doivent être des nombres entiers. Dans le cas où une valeur de la proportion contient une décimale, une correction doit être apportée pour faire disparaître cette décimale.
La correction consiste à multiplier toutes les valeurs de la proportion par un nombre qui renvoie des entiers à toutes les valeurs. Par exemple, si une valeur de la proportion minimale est 1,25, toutes les valeurs doivent être multipliées par quatre (4). Puisque 1,25 fois 4 est égal à 5, un nombre entier.
Quatrième étape
Tous les symboles chimiques des éléments du composé seront placés et avec leur indice correspondant; c'est-à-dire la valeur de la proportion minimale de l'élément.
Cinquième étape
La formule minimale d'un composé peut être transformée en sa formule moléculaire en obtenant le rapport entre le poids moléculaire du composé et le poids de sa formule minimale (n). Cette relation est la même que celle qui existe entre la formule moléculaire et la formule minimale.
n = poids moléculaire du composé / poids de formule minimale
Pour obtenir la formule moléculaire, la formule minimale doit être multipliée par n. Cela implique que chacun des indices de la formule minimum doit être multiplié par n.
n = poids moléculaire / poids minimum de la formule
= Formule moléculaire / Formule minimale
Formule moléculaire = n formule minimale
Exemples de formules moléculaires
Certaines formules moléculaires courantes sont énumérées ci-dessous:
-Oxyde ferreux (FeO)
-Hydroxyde de sodium (NaOH)
-Oxyde de potassium (KdeuxOU ALORS)
-Oxyde perchlorique (CldeuxOU ALORS7)
-Hydroxyde ferrique [Fe (OH)3]
-Chlorure de calcium (CaCldeux)
-Acide chlorhydrique (HCl)
-Sulfate de sodium (NdeuxSW4)
-Acide sulfurique (HdeuxSW4)
-Acide perbromique (HBrO4)
-Chlorure d'aluminium (AlCl3)
-Méthane (CH4)
-Propane (C3H8)
-Éthane (CdeuxH6)
-Alcool éthylique (CdeuxH6OU ALORS)
-Acide acétique (CdeuxH4OU ALORSdeux)
-Benzène (C6H6)
-Glucose (C6H12OU ALORS6)
Exercices résolus
- Exercice 1
Le benzoate de méthyle a les pourcentages massiques suivants:
C: 70,57%,
H: 5,93%
Soit: 23,49%
Et un poids moléculaire de 136,1 g / mol. Déterminez la formule moléculaire.
Premier pas
La première étape consiste à exprimer les pourcentages massiques des éléments dans leurs masses en grammes, sachant que les pourcentages massiques sont en relation avec le poids moléculaire..
Sur les 136,1 grammes correspondant à la mole du composé, 70,57% ne représentent que du carbone. Et ainsi de suite avec les éléments restants:
Masse de carbone = 136,1 g (70,57 / 100)
= 96,05 g
Masse d'hydrogène = 136,1 g (5,93 / 100)
= 8,06 g
Masse d'oxygène = 136,1 (23,49 / 100)
= 31,96 g
Deuxième pas
Lors de l'élaboration de la formule moléculaire, les nombres relatifs d'atomes (NRA) doivent être déterminés. Pour ce faire, les masses des éléments sont divisées par leurs masses atomiques:
NRA (C) = 96 g / 12 g
= 8
NRA (H) = 8 g / 1 g
= 8 g
NRA (O) = 32 g / 16 g
= 2
Troisième étape
Il faut alors calculer les proportions minimales des éléments (PME). Pour ce faire, toutes les valeurs NRA sont divisées par la valeur NRA la plus basse:
PME (C) = 8/2
= 4
PME (H) = 8/2
= 4
PME (O) = 2/2
= 1
Quatrième étape
Écrivez la formule minimale pour le benzoate de méthyle, en vous basant sur le fait que les indices des éléments sont leurs proportions minimales calculées:
C4H4OU ALORS
Cinquième étape
Enfin, la formule moléculaire du benzoate de méthyle doit être établie. On calcule donc n:
n = poids moléculaire / poids minimum de la formule
Le poids de la formule minimale est de 68 g / mol:
= 136,1 g / 68 g
n ≈ 2
Formule moléculaire = 2 formule minimum
= 2 C4H4OU ALORS
Formule moléculaire du benzoate de méthyle = C8H8OU ALORSdeux
- Exercice 2
Les pourcentages des éléments qui composent le benzène sont les suivants:
C: 92,36%
H: 7,64%.
Le poids moléculaire du benzène est de 78 g / mol. Déterminez votre formule moléculaire.
Premier pas
Transformez les pourcentages massiques des éléments en leurs masses en grammes:
Masse de carbone = 78 g (92,36 / 100)
= 72,04 g
Masse d'hydrogène = 78 g (7,64 / 100)
= 5,96 g
Deuxième pas
Calcul des nombres relatifs d'atomes (NRA). Pour ce faire, les masses des éléments sont divisées par leurs masses atomiques:
NRA (C) = 72 g / 12 g
= 6
NRA (H) = 6 g / 1 g
= 6
Troisième étape
Calcul des valeurs de la proportion minimale des éléments (PME). Ceci est calculé en divisant les valeurs NRA de tous les éléments par la plus petite valeur NRA:
PME (C) = 6/6
= 1
PME (H) = 6/6
= 1
Quatrième étape
Ecrire la formule minimale pour le benzène, en tenant compte du fait que les indices des éléments sont les valeurs de la proportion minimale calculée.
Formule minimum de benzène: CH
Cinquième étape
Etablissement de la formule moléculaire en calculant la relation entre la masse moléculaire et la masse de la formule minimale:
n = poids moléculaire / poids de la formule minimale
= 78 g / 13 g
n = 6
Formule moléculaire = n formule minimale
= 6CH
= C6H6
Les références
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE.
- Wikipédia. (2020). Formule chimique. Récupéré de: en.wikipedia.org
- Apprentissage sans limites. (s.f.). Formules moléculaires. Récupéré de: courses.lumenlearning.com
- Helmenstine, Anne Marie, Ph.D. (29 septembre 2019). Calculez les formules empiriques et moléculaires. Récupéré de: thinkco.com
- Peter J. Mikulecky, Chris Hren. (2020). Comment utiliser des formules empiriques pour trouver des formules moléculaires. Récupéré de: dummies.com



Personne n'a encore commenté ce post.