
Histoire du phosphore, propriétés, structure, obtention, utilisations
le correspondre C'est un élément non métallique qui est représenté par le symbole chimique P et qui porte le numéro atomique 15. Il a trois formes allotropiques principales: le phosphore blanc, rouge et noir. Le phosphore blanc est phosphorescent, brûle spontanément lorsqu'il est exposé à l'air et est également très toxique..
Le phosphore blanc à une température de 250 ºC devient du phosphore rouge; une forme polymère insoluble qui ne brûle pas à l'air. Aux températures et pressions élevées, ainsi qu'en présence ou non de catalyseurs, on obtient du phosphore noir, qui ressemble au graphite et est un bon conducteur d'électricité..

Le phosphore a été isolé pour la première fois par H. Brand en 1669. Pour cela, il a utilisé l'urine comme source de cet élément. En 1770, W. Scheele a découvert qu'il pouvait également isoler le phosphore des os.
Plus tard, en raison de la création du four électrique par J. Burgess Readman (1800), les roches phosphatées sont devenues la principale source de production de phosphore à partir de la fluoroapatite minérale, présente en eux..
Le phosphore est le douzième élément le plus abondant de la croûte terrestre, représentant 0,1% de celui-ci en poids. De plus, c'est le sixième élément en abondance dans le corps humain; principalement concentré dans les os sous forme d'hydroxylapatite.
C'est donc un élément essentiel pour les êtres vivants, devenant l'un des trois principaux nutriments des plantes. Le phosphore fait partie de la structure chimique des acides nucléiques; de composés de stockage d'énergie (ATP), coenzymes; et en général, des composés du métabolisme.
Index des articles
- 1 Histoire
- 1.1 - Découverte
- 1.2 - Développement industriel
- 2 Propriétés physiques et chimiques
- 2.1 Apparence
- 2.2 Poids atomique
- 2.3 Numéro atomique (Z)
- 2.4 Point de fusion
- 2.5 Point d'ébullition
- 2.6 Densité (température ambiante)
- 2.7 Chaleur de fusion
- 2.8 Chaleur de vaporisation
- 2.9 Capacité thermique molaire
- 2.10 états d'oxydation
- 2.11 Electronégativité
- 2.12 Énergie d'ionisation
- 2.13 Conductivité thermique
- 2.14 Ordre magnétique
- 2.15 Isotopes
- 2.16 Phosphorescence
- 2.17 Changements allotropiques
- 2.18 Solubilité
- 2.19 Réactivité
- 3 Structure et configuration électronique
- 3.1 - Liens et unité tétraédrique
- 3.2 - Allotropes
- 4 Où trouver et obtenir
- 4.1 Apatite et phosphorite
- 4.2 Réduction électrothermique de la fluoroapatite
- 5 alliages
- 5.1 Cuivre
- 5.2 Bronze
- 5.3 Nickelé
- 6 risques
- 7 utilisations
- 7.1 - Phosphore élémentaire
- 7.2 - Composés
- 8 Références
Histoire
- Découverte
Dans l'urine

Le phosphore a été isolé par Henning Brand en 1669, étant le premier humain à isoler un élément. Brand était un alchimiste allemand de Hambourg et a réussi à obtenir un composé de phosphore à partir de l'urine. Pour ce faire, il a collecté l'urine de 50 seaux et l'a laissée se décomposer.
Brand a ensuite évaporé l'urine et obtenu un résidu noirâtre, qu'il a conservé pendant plusieurs mois. À cela, il a ajouté du sable et l'a chauffé, parvenant à éliminer les gaz et les huiles. Finalement, il a obtenu un solide blanc qui brillait dans l'obscurité avec une couleur verte, qu'il appelait «feu froid»..
Le terme «phosphore» vient par coïncidence du mot grec «Phosphoros» qui signifie porteur de lumière..
Brand n'a pas publié ses résultats expérimentaux et les a vendus à divers alchimistes, notamment: Johann Kraft, Kunckel Lowenstern et Wilhelm Leibniz. Probablement, certains d'entre eux ont rapporté le travail de Brand à l'Académie des Sciences de Paris, diffusant ainsi leurs recherches.
Cependant, Brand n'a pas isolé le phosphore, mais le phosphate de sodium ammoniacal [Na (NH4) PO4]. En 1680, Robert Boyle a amélioré la procédure de Brand, par laquelle il a pu obtenir une forme allotropique de phosphore (P4).
Dans les os
Johan Gottlieb Gahn et Carl Wihelm Scheele ont établi en 1769 qu'un composé du phosphore, le phosphate de calcium, a été trouvé dans les os. Les os dégraissés ont été soumis à un processus de digestion avec des acides forts, tels que l'acide sulfurique.
Ensuite, le produit de digestion a été chauffé dans des conteneurs en acier avec du charbon et du charbon, obtenant ainsi du phosphore blanc par distillation dans des cornues. Les os étaient la principale source de phosphore jusqu'en 1840, date à laquelle ils ont été remplacés à cet effet par le guano..
Dans le guano
Le guano est un mélange d'excréments d'oiseaux et de produits de décomposition d'oiseaux. Il était utilisé comme source de phosphore et d'engrais au 19e siècle.
- Développement industriel
Les roches phosphatées ont été utilisées en 1850 comme source de phosphore. Ceci, combiné à l'invention du four électrique pour la calcination des roches par James Burgess Readman (1888), a fait des roches phosphatées la principale matière première pour la production de phosphore et d'engrais..
En 1819, les usines d'allumettes ont été établies, commençant le développement industriel de l'utilisation du phosphore..
Proprietes physiques et chimiques
Apparence
Selon la forme allotrope, il peut être incolore, blanc cireux, jaune, écarlate, rouge, violet ou noir.
Poids atomique
30 973 unités
Numéro atomique (Z)
quinze
Point de fusion
Phosphore blanc: 44,15 ºC
Phosphore rouge: ~ 590 ºC
Point d'ébullition
Phosphore blanc: 280,5 ºC
Densité (température ambiante)
Blanc: 1,823 g / cm3
Rouge: 2,2-2,34 g / cm3
Violet: 2,36 g / cm3
Noir: 2,69 g / cm3
Température de fusion
Phosphore blanc: 0,66 kJ / mol
Chaleur de vaporisation
Phosphore blanc: 51,9 kJ / mol
Capacité thermique molaire
Phosphore blanc: 23,824 J / (mol.K)
États d'oxydation
-3, -2, -1, +1, +2, +3, +4 et +5
En fonction de l'électronégativité des éléments avec lesquels il se combine, le phosphore peut montrer l'état d'oxydation +3 ou -3. Le phosphore, contrairement à l'azote, a tendance à réagir préférentiellement avec l'état d'oxydation +5; c'est le cas du pentoxyde de phosphore (PdeuxOU ALORS5 ou Pdeux5+OU ALORS5deux+).
Électronégativité
2.19 sur l'échelle de Pauling
Énergie d'ionisation
-Premièrement: 1101 kJ / mol
-Deuxième: 2190,7 kJ / mol
-Troisième: 2914 kJ / mol
Conductivité thermique
Phosphore blanc: 0,236 W / (mK)
Phosphore noir: 12,1 W / (mK)
Il montre comment le phosphore noir conduit presque six fois plus de chaleur que le phosphore blanc.
Ordre magnétique
Les phosphores blancs, rouges, violets et noirs sont diamagnétiques.
Les isotopes
Le phosphore a 20 isotopes, les principaux étant: 31P, le seul isotope stable avec une abondance de 100%; 32Isotope émetteur de P, β- et avec une demi-vie de 14,28 jours; Oui 33P, un isotope émetteur de β- et avec une demi-vie de 25,3 jours.
Phosphorescence
Le phosphore blanc est phosphorescent et émet une lumière verte dans l'obscurité.
Changements allotropiques
Le phosphore blanc est instable et change à des températures proches de 250 ° C en une forme polymère connue sous le nom de phosphore rouge, qui peut varier de l'orange au violet. C'est une substance amorphe, mais elle peut devenir cristalline; ne brille pas dans l'obscurité ou ne brûle pas dans l'air.
Le phosphore blanc à des températures et pressions élevées, ou en présence de catalyseurs, se transforme en une forme polymérique autre que le phosphore rouge: le phosphore noir. C'est une substance cristalline de couleur noire, inerte, semblable au graphite, et qui a la capacité de conduire l'électricité.
Solubilité
Le phosphore blanc sous forme pure est insoluble dans l'eau, bien qu'il puisse être solubilisé dans le sulfure de carbone. Pendant ce temps, les phosphores rouges et noirs sont insolubles dans l'eau et sont moins volatils que le phosphore blanc..
Réactivité
Le phosphore brûle spontanément dans l'air pour former du PdeuxOU ALORS5, et cela à son tour peut réagir avec trois molécules d'eau pour former de l'acide orthophosphorique ou phosphorique (H3PO4).
Par l'action de l'eau chaude, la phosphine (PH3) et les oxydes de phosphore.
L'acide phosphorique agit sur les roches phosphatées, provoquant le phosphate de dihydrogène calcique ou le superphosphate [Ca (HdeuxPO4)deux].
Peut réagir avec les halogènes pour former des halogénures PX3, X représentant F, Cl, Br ou I; ou halogénures de formule PX5, où X est le F, Cl ou Br.
De plus, le phosphore réagit avec les métaux et les métalloïdes pour former des phosphures et avec le soufre pour former divers sulfures. D'autre part, il se lie à l'oxygène pour créer des esters. De la même manière, il se combine avec le carbone pour former des composés organiques phosphorés..
Structure et configuration électronique
- Obligations et unité tétraédrique
Les atomes de phosphore ont la configuration électronique suivante:
[Ne] 3sdeux 3p3
Il possède donc cinq électrons de valence, tels que l'azote et les autres éléments du groupe 15. Comme il s'agit d'un élément non métallique, ses atomes doivent former des liaisons covalentes jusqu'à ce que l'octet de valence soit complété. L'azote y parvient en s'établissant comme des molécules diatomiques Ndeux, avec une triple liaison, N≡N.
La même chose se produit avec le phosphore: deux de ses atomes P se lient avec une triple liaison pour former la molécule Pdeux, P≡P; c'est-à-dire l'allotrope diphosphoreux. Cependant, le phosphore a une masse atomique plus élevée que l'azote, et ses orbitales 3p, plus diffuses que le 2p de l'azote, se chevauchent moins efficacement; par conséquent, le Pdeux n'existe qu'à l'état gazeux.
Au lieu de cela, à température ambiante, les atomes P préfèrent s'organiser de manière covalente d'une autre manière: dans une molécule tétraédrique P4:

Notez que dans l'image du haut, tous les atomes P ont trois liaisons simples au lieu d'une triple liaison. Ainsi, le phosphore dans P4 complète son octet de valence. Cependant, dans le P4 il y a une tension dans les liaisons P-P, car leurs angles sont éloignés de 109,5 ° à l'œil nu.
- Allotropes
Phosphore blanc
Même image des unités P4 et son instabilité expliquent pourquoi le phosphore blanc est l'allotrope le plus instable de cet élément.
Unités P4 ils sont disposés dans l'espace pour définir un cristal bcc (phase α) dans des conditions normales. Lorsque la température chute à -77,95 ° C, le cristal bcc se transforme en un hcp plus dense (vraisemblablement) (phase β). Autrement dit, les unités P4 ils sont disposés en deux couches alternées, A et B, pour établir une séquence ABAB ...
Phosphore rouge
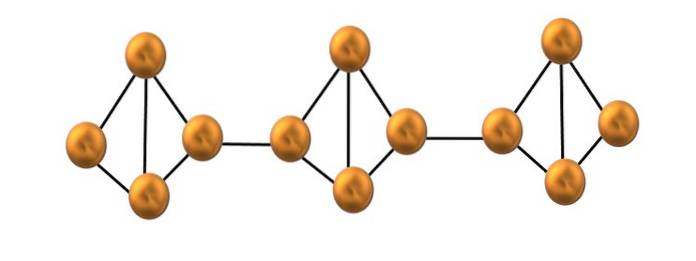
Seul un petit segment de la structure du phosphore rouge est représenté sur l'image du haut. Comme les trois unités sont alignées "symétriquement", on peut dire qu'il s'agit d'une structure cristalline, qui est obtenue en chauffant ce luminophore au-dessus de 250 ° C..
Le phosphore rouge, cependant, se compose la plupart du temps d'un solide amorphe, de sorte que sa structure est désordonnée. Ensuite, les chaînes polymères de P4 serait disposé sans motif apparent, certains au-dessus et d'autres au-dessous du même plan arbitrairement.
Notez que c'est la principale différence structurelle entre le phosphore blanc et rouge: dans le premier, le P4 ils sont individuels, et dans les secondes chaînes de formation. Ceci est possible car l'une des liaisons P-P au sein du tétraèdre est rompue afin de se lier au tétraèdre voisin. Ainsi, la tension annulaire est réduite et le phosphore rouge gagne en stabilité..
Lorsqu'il y a un mélange des deux allotropes, il est offert à l'œil sous forme de luminophore jaune; un mélange de tétraèdres et de chaînes phosphorées amorphes. En effet, le phosphore blanc devient jaunâtre lorsqu'il est exposé aux rayons du soleil, car le rayonnement favorise la rupture de la liaison P-P déjà mentionnée..
Phosphore violet ou Hittorf
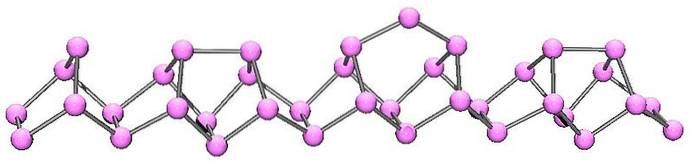
Le phosphore violet est la dernière évolution du phosphore rouge. Comme on peut le voir sur l'image ci-dessus, il est toujours constitué d'une chaîne polymère; mais maintenant les structures sont plus complexes. Il semble que l'unité structurelle n'est plus le P4 mais le Pdeux, disposés de manière à former des anneaux pentagonaux irréguliers.
Malgré l'aspect asymétrique de la structure, ces chaînes polymères parviennent à s'organiser suffisamment bien et avec une périodicité pour que le luminophore violet établisse des cristaux monocliniques..
Phosphore noir
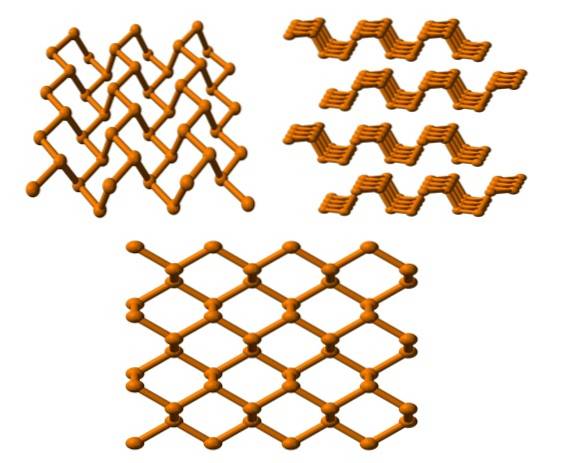
Et enfin, nous avons l'allotrope de phosphore le plus stable: le noir. Il est préparé en chauffant du phosphore blanc sous une pression de 12000 atm.
Sur l'image du haut (ci-dessous), on peut voir que sa structure, d'un plan supérieur, a une certaine ressemblance avec celle du graphite; est un réseau raide d'anneaux hexagonaux (même s'ils ressemblent à des carrés).
Dans le coin supérieur gauche de l'image, ce qui vient d'être commenté peut être mieux apprécié. L'environnement moléculaire des atomes P sont des pyramides trigonales. Notez que la structure vue de côté (coin supérieur droit), est disposée en couches qui s'emboîtent les unes sur les autres.
La structure du phosphore noir est assez symétrique et ordonnée, ce qui est cohérent avec sa capacité à s'établir comme des cristaux orthorhombiques. L'empilement de leurs couches polymères rend les atomes P indisponibles pour de nombreuses réactions chimiques; et c'est pourquoi il est considérablement stable et peu réactif.
Bien que cela vaille la peine d'être mentionné, les forces de dispersion de Londres et les masses molaires de ces solides phosphoriques sont ce qui régit certaines de leurs propriétés physiques; tandis que leurs structures et liaisons P-P définissent les propriétés chimiques et autres.
Où trouver et obtenir
Apatite et phosphorite
C'est le douzième élément de la croûte terrestre et en représente 0,1% en poids. Il y a environ 550 minéraux qui contiennent du phosphore, l'apatite étant le minéral le plus important pour obtenir du phosphore..
L'apatite est un minéral de phosphore et de calcium qui peut contenir des quantités variables de fluor, de chlorure et d'hydroxyde, dont la formule est la suivante: [Cadix(PO4)6(F, Cl ou OH)deux)]. Outre l'apatite, il existe d'autres minéraux phosphoreux d'importance commerciale; tel est le cas de wavelita et vivianita.
La roche phosphatée ou le phosphorite est la principale source de phosphore. C'est une roche sédimentaire non détritique qui a une teneur en phosphore de 15 à 20%. Le phosphore est généralement présent sous forme de Cadix(PO4)6Fdeux (fluoroapatite). Il est également présent sous forme d'hydroxyapatite, bien que dans une moindre mesure.
De plus, la fluoroapatite fait partie des roches ignées et métamorphiques, ainsi que du calcaire et des schistes..
Réduction électrothermique de la fluoroapatite
Les roches phosphatées sélectionnées sont transférées à l'usine de traitement pour traitement. Dans un premier temps, ils sont concassés pour obtenir des fragments rocheux qui sont ensuite broyés dans des broyeurs à boulets à 70 tours par minute.
Ensuite, le produit du broyage des fragments de roche est tamisé afin de pouvoir les fractionner. Les fractions avec une teneur en phosphore de 34% sont choisies comme pentoxyde de phosphore (PdeuxOU ALORS5).
Phosphore blanc (P4) est obtenu industriellement par réduction électrothermique de fluoroapatite avec du carbone à une température de 1500 ºC en présence d'oxyde de silicium:
2Ca3(PO4)deux(s) + 6SiOdeux(s) + 10 C (s) => P4(g) + CaSiO3(l) + CO (g)
Le p4 à l'état gazeux, après condensation, il est collecté et stocké sous forme de solide blanc immergé dans l'eau pour l'empêcher de réagir avec l'air extérieur.
Alliages
Cuivré
La couverture de phosphore est fabriquée avec différents pourcentages de cuivre et de phosphore: Cu 94% - P 6%; Cu 92% - P 8%; Cu 85% - P 15%, etc. L'alliage est utilisé comme désoxydant, agent mouillant pour l'industrie du cuivre et également comme agent de nucléation dans l'industrie de l'aluminium.
Broncíneas
Ce sont des alliages de cuivre, de phosphore et d'étain qui contiennent 0,5 à 11% de phosphore et 0,01 à 0,35% d'étain. L'étain augmente la résistance à la corrosion, tandis que le phosphore augmente la résistance à l'usure de l'alliage et lui confère sa rigidité.
Il est utilisé dans la fabrication de ressorts, de boulons et, en général, dans des articles qui nécessitent une résistance à la fatigue, à l'usure et à la corrosion chimique. Son utilisation est recommandée dans les hélices des bateaux.
Plaqué nickel
L'alliage le plus connu est le NiPvingt, utilisation de nickel phosphoreux dans les alliages de brasage pour améliorer leur résistance à l'érosion chimique, à l'oxydation et aux températures élevées.
L'alliage est utilisé dans les composants de turbines à gaz et de moteurs à réaction, la galvanoplastie et dans la production d'électrodes de soudage.
Des risques
Le phosphore blanc provoque de graves brûlures cutanées et est un poison puissant qui peut être mortel à une dose de 50 mg. Le phosphore inhibe l'oxydation cellulaire, interférant avec la gestion de l'oxygène cellulaire, ce qui peut entraîner une dégénérescence graisseuse et la mort cellulaire.
L'intoxication aiguë au phosphore produit dans les quatre premiers jours de l'ingestion des douleurs abdominales, des brûlures, une haleine odorante d'ail, des vomissements phosphorescents, de la transpiration, des crampes musculaires et même un état de choc..
Plus tard, jaunisse, pétéchies, hémorragie, atteinte myocardique avec arythmies, altération du système nerveux central et décès le dixième jour après l'ingestion..
La manifestation la plus évidente de l'intoxication chronique au phosphore est une lésion de la structure osseuse de la mâchoire.
Une augmentation de la concentration plasmatique de phosphore (hyperphosphatémie) survient généralement chez les patients atteints d'insuffisance rénale. Cela provoque un dépôt anormal de phosphates dans les tissus mous, ce qui peut entraîner un dysfonctionnement vasculaire et des maladies cardiovasculaires..
Applications
Le phosphore est un élément essentiel pour les plantes et les animaux. C'est l'un des trois principaux nutriments des plantes, nécessaire à leur croissance et à leurs besoins énergétiques. De plus, il fait partie des acides nucléiques, des phospholipides, des produits intermédiaires des processus métaboliques, etc..
Chez les vertébrés, le phosphore est présent dans les os et les dents sous forme d'hydroxylapatite..
- Phosphore élémentaire

Avec le phosphore, on fabrique un émail chimique qui est utilisé pour éclairer les enseignes placées sur l'aluminium et ses alliages; ainsi que le cuivre et le bronze phosphoreux.
Il est également utilisé pour fabriquer des bombes incendiaires, des grenades, des bombes fumigènes et des balles traçantes. Le phosphore rouge est utilisé pour fabriquer des allumettes ou des allumettes de sécurité.
Le phosphore blanc est utilisé pour fabriquer des organophosphorés. De plus, il est utilisé dans la production d'acide phosphorique.
Une grande quantité du phosphore produit est incinérée pour la production de tétraoxyde de phosphore (P4OU ALORSdix), obtenu sous forme de poudre ou de solide.
- Composés
Phosphine
C'est la matière première pour la production de divers composés du phosphore. Agit comme agent dopant pour les composants électroniques.
Acide phosphorique
Il est utilisé dans la production de boissons gazeuses en raison de la saveur caractéristique qu'il leur confère. Il agit sur les roches phosphatées pour former du dihydrogénophosphate de calcium [Ca (HdeuxPO4)deux], également connu sous le nom de superphosphate, utilisé comme engrais.
L'acide phosphorique est un élément conditionneur de l'émail dentaire pour faciliter l'adhérence de vos matériaux de restauration. Il est également utilisé, mélangé avec de l'huile, de l'urée, du goudron, du bitume et du sable, pour former de l'asphalte; matériel utilisé pour la réparation des voies de communication terrestres.
Organophosphates
Les composés organophosphorés ont de nombreuses applications; tels que: retardateurs de flamme, pesticides, agents d'extraction, agents neurotoxiques et pour le traitement de l'eau.
Dihydrate de phosphate de calcium dihydrogène
Il est utilisé comme engrais, levure chimique, additif pour l'alimentation animale et dans la fabrication de dentifrices.
Pentoxyde de phosphore
Il est utilisé en analyse chimique comme agent déshydratant et en synthèse organique comme agent de condensation. Le composé est principalement destiné à la production d'acide orthophosphorique.
Tripolyphosphate de sodium
Utilisé dans les détergents et comme adoucisseur d'eau, ce qui améliore l'action des détergents et aide à prévenir la corrosion des tuyaux.
Phosphate trisodique
Utilisé comme agent de nettoyage et adoucisseur d'eau.
Phosphates de sodium
Phosphate de sodium dibasique (NadeuxHPO4) et phosphate de sodium monobasique (NaHdeuxPO4) sont les composants d'un système tampon de pH, qui agit même sur les êtres vivants; y compris les êtres humains.
Les références
- Reid Danielle. (2019). Allotropes de phosphore: formes, utilisations et exemples. Étude. Récupéré de: study.com
- Prof. Robert J. Lancashire. (2014). Conférence 5c. Structure des éléments, suite P, S et I. Récupéré de: chem.uwimona.edu.jm
- BYJU'S. (2019). Phosphore rouge. Récupéré de: byjus.com
- Bing Li, Ceng-Ceng Ren, Shu-Feng Zhang et coll. (2019). Propriétés structurelles et optiques électroniques du phosphore bleu multicouche: une étude de premier principe. Journal of Nanomaterials, vol. 2019, numéro d'article 4020762, 8 pages. doi.org/10.1155/2019/4020762
- Dr Dough Stewar. (2019). Faits sur les éléments de phosphore. Chemicool. Récupéré de: chemicool.com
- Wikipédia. (2019). Phosphore. Récupéré de: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (03 juillet 2019). Faits sur le phosphore (numéro atomique 15 ou symbole d'élément P). Récupéré de: thinkco.com
- Institut Linus Pauling. (2019). Phosphore. Récupéré de: lpi.oregonstate.edu
- Bernardo Fajardo P. et Héctor Lozano V. (s.f.). Traitement national de la roche phosphatée pour la production de superphosphates. [PDF]. Récupéré de: bdigital.unal.edu.co
- Les rédacteurs de l'Encyclopaedia Britannica. (16 novembre 2018). Élément chimique phosphore. Encyclopædia Britannica. Récupéré de: britannica.com
- Reade International Corp. (2018). Alliage de cuivre et de phosphore (CuP). Récupéré de: reade.com
- KBM Affilips. (27 décembre 2018). Alliage principal de nickel et de phosphore (NiP). AZoM. Récupéré de: azom.com
- Lenntech B.V. (2019). Tableau périodique: phosphore. Récupéré de: lenntech.com
- Abhijit Naik. (2018, 21 février). Utilisations du phosphore. Récupéré de: sciencestruck.com


Personne n'a encore commenté ce post.