
Stades glycogénolyse, devenir du glucose, régulation, maladies

La glycogénolyse C'est le processus de lyse ou de dégradation du glycogène. Il s'agit d'une voie enzymatique de type catabolique (destruction) qui implique la dégradation du glycogène et la libération de glucose-6-phosphate.
Le glycogène est une substance utilisée comme réserve de glucose. Il se trouve dans le cytoplasme des cellules et est particulièrement abondant dans les cellules hépatiques et musculaires des animaux..
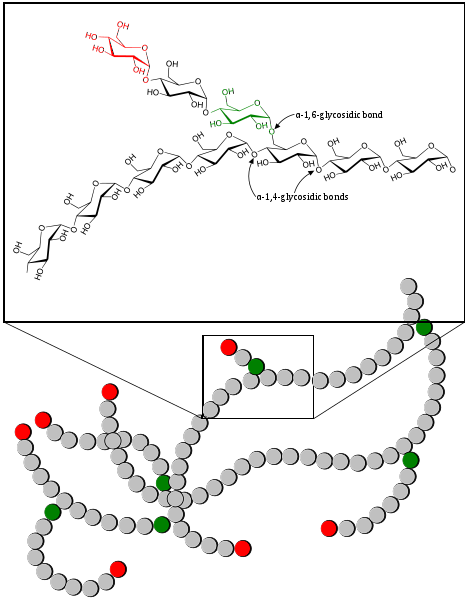
C'est une molécule que certains auteurs définissent comme un «arbre du glucose», car elle a une structure ramifiée. C'est un homopolymère composé d'unités répétitives de résidus de glucose, qui sont liés entre eux par des liaisons α-1,4 et α-1,6..
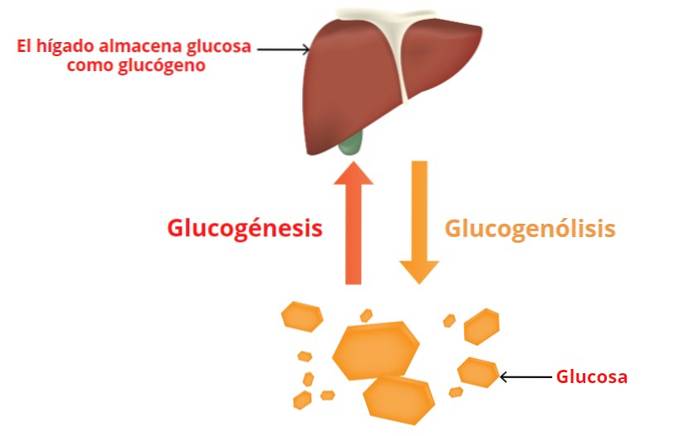
Lorsque le glucose est nécessaire, il peut être obtenu à partir de plusieurs sources: par glycogénolyse, à partir de glucose circulant dans le sang ou à partir des mécanismes de production de glucose à travers des substances non glycosidiques. Ce dernier mécanisme est appelé gluconéogenèse et se produit principalement dans le foie et les reins..
Index des articles
- 1 D'où vient le glucose et où va-t-il??
- 2 étapes de glycogénolyse
- 2.1 Phase 1: libération de résidus de glucose 1-phosphate
- 2.2 Phase 2: suppression des branches
- 3 Destination du glucose
- 4 Règlement
- 4.1 - Régulation de la glycogénolyse dans le foie
- 4.2 - Régulation de la glycogénolyse dans le muscle
- 5 Maladies liées au stockage du glycogène
- 5.1 Maladie de von Gierke
- 5.2 Maladie de McArdle
- 5.3 Sa maladie
- 6 Références
D'où vient le glucose et où va-t-il??
- La glycémie provient du système digestif et des processus d'approvisionnement presque exclusifs du foie.
- Lorsque la glycogénolyse se produit dans le muscle, le glucose libéré entre dans les processus métaboliques qui visent la production d'ATP (énergie cellulaire).
- Dans le foie, le glucose issu de la glycogénolyse passe dans le sang, produisant de manière concomitante une augmentation de la glycémie (concentration de glucose dans le sang).
Étapes de la glycogénolyse
La glycogénolyse est un processus qui ne peut être considéré comme l'inverse de la synthèse du glycogène ou de la glycogenèse, c'est une voie différente.
Phase 1: libération de résidus de glucose 1-phosphate
La dégradation du glycogène commence par l'action d'une enzyme spécifique appelée glycogène phosphorylase, qui est responsable de la «rupture» des liaisons α-1,4 du glycogène, libérant du glucose 1-phosphate. Le mécanisme de clivage est une phosphorolyse.
Grâce à cette enzyme, les résidus glycosidiques des chaînes de glycogène les plus externes sont séparés, jusqu'à ce qu'il y ait environ quatre résidus de glucose de chaque côté de chaque branche..
Dans le glycogène, les molécules de glucose sont liées par des liaisons α-1,4, mais aux sites de ramification, les liaisons sont de type α-1,6.
Phase 2: suppression des branches
Lorsque quatre résidus de glucose restent près des points de ramification, une enzyme, α-1,4 → α-1,4 glucane transférase, transfère une unité trisaccharidique d'une branche à une autre, exposant le point de ramification 1 → 6.
L'enzyme de déramification, en particulier l'amyl 1 → 6 glucosidase, hydrolyse les liaisons α-1,6. De cette manière, par l'action séquentielle de ces trois enzymes (phosphorylase, glucane transférase et enzyme de déramification), le clivage complet du glycogène se produit..
Le glucose 1-phosphate du glycogène est transformé en glucose 6-phosphate par une réaction réversible catalysée par la phosphoglucomutase. Dans cette réaction, le phosphate du carbone 1 "se déplace" vers le carbone 6 sous l'effet de cette enzyme et c'est ainsi que la glycogénolyse se termine..
Destination du glucose
Dans le foie, il existe une enzyme appelée glucose 6-phosphatase qui élimine le phosphate du carbone 6 du glucose et le convertit en glucose «libre», qui est transporté à travers les parois cellulaires et passe dans le sang.
Le muscle ne peut pas fournir de glucose à la circulation sanguine, car il ne possède pas cette enzyme et le glucose phosphorylé est "piégé" à l'intérieur des cellules musculaires..
Le glucose 6-phosphate dans le muscle entre dans la glycolyse, un processus catabolique pour la production d'ATP (adénosine triphosphate), particulièrement important lors de la contraction musculaire anaérobie.
Régulation
Le métabolisme du glycogène est régulé en équilibrant l'activité de deux enzymes; un qui est utilisé pour la synthèse, qui est la glycogène-synthétase et un autre qui est utilisé pour le clivage, qui est la glycogène-phosphorylase.
L'équilibre de l'activité de ces enzymes stimulera la synthèse ou la dégradation du glycogène. Les mécanismes de régulation interviennent à travers des substrats et à travers un système hormonal complexe qui implique, dans le foie, au moins quatre hormones:
- l'adrénaline
- norépinéphrine
- glucagon et
- insuline
- Régulation de la glycogénolyse dans le foie
Les hormones peuvent agir par l'intermédiaire d'un deuxième messager, qui peut être l'AMPc ou des ions calcium..
CAMP active la glycogène phosphorylase et, en même temps, inactive la glycogène synthétase. Pour cette raison, il augmente le catabolisme et diminue ou inhibe la synthèse du glycogène (anabolisme)..
Adrénaline et noradrénaline
L'épinéphrine et la noradrénaline, agissant par l'intermédiaire des récepteurs β-adrénergiques, et le glucagon, agissant par l'intermédiaire de récepteurs spécifiques, augmentent les taux d'AMPc dans les cellules hépatiques. Cette augmentation de l'AMPc active la glycogène phosphorylase et le catabolisme du glycogène commence..
L'épinéphrine et la noradrénaline stimulent également la glycogénolyse par un mécanisme indépendant de l'AMPc et via les récepteurs α1-adrénergiques. Ce mécanisme stimule la mobilisation du calcium des mitochondries..
Insuline
L'insuline augmente l'activité d'une enzyme appelée phosphodiestérase, qui est responsable de la destruction de l'AMPc. En raison de l'effet de l'insuline sur le foie, les taux d'AMPc diminuent, réduisant ainsi l'activité de la phosphorylase et augmentant l'activité de la synthétase..
L'équilibre de cette activité hormonale est ce qui détermine la «direction» du métabolisme du glycogène..
- Régulation de la glycogénolyse dans le muscle
La glycogénolyse musculaire augmente immédiatement après le début de la contraction musculaire. Le calcium est l'intermédiaire qui synchronise l'activation de la phosphorylase avec la contraction.
Le calcium active une phosphorylase kinase qui, à son tour, active la glycogène-phosphorylase musculaire ou la myophosphorylase, cette enzyme est différente de celle trouvée dans le foie, mais a la même fonction.
L'insuline augmente les niveaux de glucose-6-phosphate dans les cellules musculaires en favorisant l'entrée de glucose dans la circulation sanguine. En augmentant le glucose 6-phosphate, la déphosphorylation de la glycogène-synthétase et son activation consécutive sont stimulées.
Le résultat net est une augmentation de la glycogenèse musculaire et une diminution ou une inhibition de la glycogénolyse..
Maladies liées au stockage du glycogène
L'insuffisance héréditaire de certaines enzymes spécifiques nécessaires au métabolisme hépatique et musculaire du glycogène est l'une des causes des maladies de stockage du glycogène.
Ces maladies sont appelées collectivement glycogénose. En fonction de la défaillance enzymatique présente, ils sont répertoriés par types I à VIII et sont ajoutés au fur et à mesure de leur découverte..
Certaines glycogénoses sont mortelles très tôt dans la vie, voici quelques exemples.
Les échecs enzymatiques présents dans la glycogénose génèrent une augmentation ou une accumulation excessive de glycogène, principalement dans le foie, les muscles et / ou les reins. Cependant, il existe une glycogénose qui provoque cet effet sur les érythrocytes ou les lysosomes.
Maladie de Von Gierke
La glycogénose de type I est appelée maladie de Von Gierke et est associée à une carence en glucose 6-phosphatase, ce qui augmente la charge de glycogène dans les hépatocytes et les cellules tubulaires rénales. Le patient présente une hypoglycémie, une cétose, une lactacidémie et une hyperlipidémie.
Maladie de McArdle
Dans la glycogénose de type V ou la maladie de McArdle, il existe un déficit en glycogène phosphorylase musculaire, qui se traduit par un échec de la glycogénolyse musculaire. Par conséquent, il existe une faible tolérance à l'exercice, de faibles taux de lactate dans le sang après l'exercice et des taux de glycogène très élevés dans les cellules musculaires..
Sa maladie
Dans la glycogénose de type VI ou maladie de Hers, le déficit est de l'enzyme hépatique glycogène-phosphorylase. Dans ces cas, il y a une augmentation du glycogène hépatique avec une tendance à l'hypoglycémie.
Les références
- Blanco, A. et Blanco, G. (2017). Chapitre 14-Métabolisme des glucides. Biochimie médicale; Blanco, A., Blanco, G., Eds, 283-323.
- Ha, C. E. et Bhagavan, N. V. (2011). Essentiels de la biochimie médicale: avec des cas cliniques. Presse académique.
- Jones, K. M. (1990). Biochimie: par J. David Rawn, Neil Patterson Publications, (1105 pages) ISBN 0 89278405 9.
- Murray, R. K., Granner, D. K., Mayes, P. A. et Rodwell, V. W. (2014). La biochimie illustrée de Harper. Mcgraw-Hill.
- Paredes-Flores MA, Mohiuddin SS. Biochimie, glycogénolyse. [Mis à jour le 24 février 2020]. Dans: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020 janv. Disponible sur: ncbi.nlm.nih.gov


Personne n'a encore commenté ce post.