
Histoire de l'hélium, propriétés, structure, risques, utilisations
le hélium est un élément chimique dont le symbole est He. C'est le premier gaz rare du tableau périodique, et il est généralement situé à l'extrême droite de celui-ci. Dans des conditions normales, c'est un gaz inerte, car aucun de ses rares composés n'est stable; Il se dilate également très rapidement et est la substance avec le point d'ébullition le plus bas de tous.
À un niveau populaire, c'est un gaz bien connu, car dans d'innombrables événements ou fêtes d'enfants, il est courant de voir comment un ballon monte jusqu'à ce qu'il se perde dans le ciel. Cependant, ce qui est vraiment et à jamais perdu dans les coins du système solaire, et au-delà, ce sont les atomes d'hélium qui sont libérés une fois que le ballon explose ou se dégonfle..

En fait, il y a ceux qui, et à juste titre, considèrent que les ballons à l'hélium représentent une pratique inappropriée pour ce gaz. Heureusement, il a des utilisations plus importantes et intéressantes, grâce à ses propriétés physiques et chimiques qui le séparent des autres éléments chimiques..
Par exemple, l'hélium liquide est si froid qu'il peut geler n'importe quoi, comme un alliage métallique, le transformant en un matériau supraconducteur. De même, c'est un liquide qui manifeste une superfluidité, capable de grimper sur les parois d'un récipient en verre..
Son nom est dû au fait qu'il a été identifié pour la première fois sur le Soleil et non sur Terre. C'est le deuxième élément le plus abondant de tout l'Univers et, bien que sa concentration soit négligeable dans la croûte terrestre, il peut être obtenu à partir des réserves de gaz naturel et de minéraux radioactifs d'uranium et de thorium..
Ici l'hélium démontre un autre fait curieux: c'est un gaz beaucoup plus abondant dans le sous-sol que dans l'atmosphère, où il finit par s'échapper de la Terre et de son champ gravitationnel..
Index des articles
- 1 Histoire
- 2 Propriétés physiques et chimiques
- 2.1 Apparence
- 2.2 Numéro atomique (Z)
- 2.3 Masse molaire
- 2.4 Point de fusion
- 2.5 Point d'ébullition
- 2.6 Densité
- 2.7 Point triple
- 2.8 Point critique
- 2.9 Chaleur de fusion
- 2.10 Chaleur de vaporisation
- 2.11 Capacité thermique molaire
- 2.12 Pression de vapeur
- 2.13 Énergies d'ionisation
- 2.14 Solubilité
- 2.15 Réactivité
- 2.16 nombre d'oxydation
- 3 Structure et configuration électronique
- 3.1 Dimères
- 3.2 Hélium II
- 3.3 Cristaux
- 4 Où trouver et obtenir
- 4.1 Cosmos et roches
- 4.2 Air et mers
- 4.3 Liquéfaction et distillation du gaz naturel
- 5 isotopes
- 6 risques
- 7 utilisations
- 7.1 Systèmes de pression et de purge
- 7.2 Détections de fuites
- 7.3 Gaz vecteur
- 7.4 Ballons et dirigeables
- 7.5 Plongée
- 7.6 Soudures à l'arc
- 7.7 Supraconducteurs
- 8 Références
Histoire
L'hélium n'a pas été découvert sur Terre mais sur le Soleil. En fait, son nom vient du mot grec «helios» qui signifie soleil. L'existence de l'élément en lui-même contrastait avec le tableau périodique de Dmitri Mendeleev, car il n'y avait pas de place pour un nouveau gaz; c'est-à-dire qu'à ce moment-là, absolument rien n'était suspecté sur les gaz rares.
Le nom «hélium», écrit comme «hélium» en anglais, se terminait par le suffixe -ium le désignant comme un métal; précisément parce que l'existence d'un gaz autre que l'oxygène, l'hydrogène, le fluor, le chlore et l'azote ne pouvait être admise.
Ce nom a été désigné par l'astronome anglais Norman Lockyer, qui a étudié depuis l'Angleterre ce qui a été observé par l'astronome français Jules Janssen en Inde, lors d'une éclipse solaire en 1868..
C'était une raie spectrale jaune d'un élément jusqu'alors inconnu. Lockyer a affirmé que cela était dû à la présence d'un nouvel élément chimique trouvé dans le soleil.
En 1895, près de vingt ans plus tard, le chimiste écossais Sir William Ramsay a reconnu le même spectre d'un gaz résiduel lorsqu'il a étudié un minéral radioactif: la cleveite. Donc il y avait de l'hélium ici aussi sur Terre.
Proprietes physiques et chimiques
Apparence
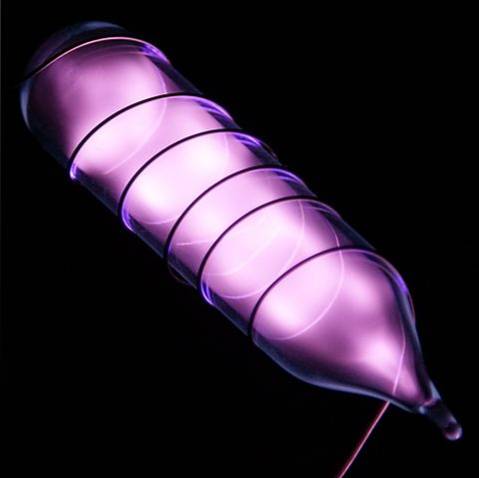
L'hélium est un gaz incolore et inodore qui n'a pas de goût et est également inerte. Cependant, lorsqu'un choc électrique est appliqué, et en fonction de la différence de tension, il commence à briller comme une brume grisâtre-violet (image ci-dessus), puis à briller avec une lueur orange. Par conséquent, les voyants d'hélium sont orange.
Numéro atomique (Z)
deux
Masse molaire
4,002 g / mol
Point de fusion
-272,2 ºC
Point d'ébullition
-268,92 ºC
Densité
-0,1786 g / L, dans des conditions normales, c'est-à-dire en phase gazeuse.
-0,145 g / ml, au point de fusion, hélium liquide.
-0,125 g / ml, au moment où l'hélium commence à bouillir.
-0,187 g / ml, à 0 K et 25 atm, c'est-à-dire hélium solide à ces conditions de pression et de température spécifiques.
Point triple
2,177 K et 5,043 kPa (0,04935 atm)
Point critique
5,1953 K et 0,22746 MPa (2,2448 atm)
Température de fusion
0,0138 kJ / mol
Chaleur de vaporisation
0,0829 kJ / mol
Capacité thermique molaire
20,78 J / (mol K)
La pression de vapeur
0,9869 atm à 4,21 K..
Énergies d'ionisation
-Premièrement: 2372,3 kJ / mol (He+ gazeux)
-Deuxième: 5250,5 kJ / mol (Hedeux+ gazeux)
Les énergies d'ionisation de l'hélium sont particulièrement élevées car l'atome gazeux doit perdre un électron, qui subit une forte charge nucléaire efficace. On peut aussi le comprendre en considérant la petite taille de l'atome et la «proximité» des deux électrons du noyau (avec ses deux protons et ses deux neutrons).
Solubilité
Dans l'eau, 0,97 mL est dissous pour 100 mL d'eau à 0 ºC, ce qui signifie qu'il est peu soluble.
Réactivité
L'hélium est le deuxième élément chimique le moins réactif de la nature. Dans des conditions normales, il est correct de dire qu'il s'agit d'un gaz inerte; Jamais (semble-t-il) un composé d'hélium ne peut être manipulé dans une pièce ou un laboratoire sans que d'énormes pressions n'agissent dessus; ou peut-être des températures extrêmement élevées ou basses.
Un exemple que nous voyons dans le composé NadeuxHe, qui n'est stable que sous une pression de 300 GPa, reproduit dans une cellule à enclume en diamant.
Alors que les liaisons chimiques dans NadeuxIls sont «étranges» d'avoir leurs électrons bien situés dans les cristaux, ils sont loin d'être de simples interactions de Van der Walls et, par conséquent, ils ne sont pas simplement constitués d'atomes d'hélium piégés par des agrégats moléculaires. C'est là que se pose le dilemme entre quels composés d'hélium sont réels et lesquels ne le sont pas..
Par exemple, les molécules d'azote à haute pression peuvent piéger un atome d'hélium pour former une sorte de clathrate, He (Ndeux)Onze.
De même, il existe les complexes endoédriques de cations fullerène, C60+n et C70+n, dans les cavités desquelles ils peuvent recevoir des atomes d'hélium; et le cation moléculaire HeH+ (Il h+), trouvé dans des nébuleuses très éloignées.
Numéro d'oxydation
Quiconque essaie par curiosité de calculer le nombre d'oxydation de l'hélium dans l'un de ses composés trouvera qu'il est égal à 0. In NadeuxOn pourrait par exemple penser que sa formule correspond à des ions Na hypothétiquesdeux+j'aideux-; mais ce serait supposer qu'il a un caractère ionique pur, alors qu'en réalité ses liens sont loin de l'être.
De plus, l'hélium ne gagne pas d'électrons car il ne peut pas les accueillir dans l'orbitale 2s, énergétiquement indisponible; Il ne lui est pas non plus possible de les perdre, en raison de la petite taille de son atome et de la grande charge nucléaire effective de son noyau. C'est pourquoi l'hélium participe toujours (en théorie) en tant qu'atome He0 dans ses composés dérivés.
Structure et configuration électronique
L'hélium, comme tous les gaz observés à une échelle macroscopique, occupe le volume des conteneurs qui le stockent, ayant ainsi une forme indéfinie. Cependant, lorsque la température baisse et commence à refroidir en dessous de -269 ºC, le gaz se condense en un liquide incolore; l'hélium I, la première des deux phases liquides pour cet élément.
La raison pour laquelle l'hélium se condense à une température aussi basse est due aux faibles forces de diffusion qui maintiennent ses atomes ensemble; quelle que soit la phase considérée. Cela s'explique par sa configuration électronique:
1sdeux
Dans lequel deux électrons occupent l'orbitale atomique 1s. L'atome d'hélium peut être visualisé comme une sphère presque parfaite, dont la périphérie électronique homogène est peu sujette à la polarisation par la charge nucléaire effective des deux protons du noyau..
Ainsi, les moments dipolaires spontanés et induits sont rares et très faibles; la température doit donc se rapprocher du zéro absolu pour que les atomes He s'approchent assez lentement et parviennent à ce que leurs forces dispersives définissent un liquide; ou mieux encore, un cristal d'hélium.
Dimères
En phase gazeuse, l'espace qui sépare les atomes He est tel qu'on peut supposer qu'ils sont toujours séparés les uns des autres. A tel point que dans un flacon de petit volume, l'hélium apparaît incolore jusqu'à ce qu'il soit soumis à une décharge électrique, qui ionise ses atomes dans une brume grisâtre et peu brillante..
Cependant, en phase liquide, les atomes He, même avec leurs faibles interactions, ne peuvent plus être "ignorés". Maintenant, la force de dispersion leur permet de se rejoindre momentanément pour former des dimères: He-He ou Hedeux. Par conséquent, l'hélium I peut être considéré comme de vastes grappes de Hedeux en équilibre avec ses atomes en phase vapeur.
C'est pourquoi l'hélium I est si difficile à différencier de ses vapeurs. Si ce liquide est renversé hors de son contenant hermétique, il s'échappe sous la forme d'une fusée blanchâtre..
Hélium II
Lorsque la température baisse encore plus, touchant 2178 K (-270 972 ºC), une transition de phase se produit: l'hélium I se transforme en hélium II.
A partir de là, l'hélium liquide déjà fascinant devient un fluide superfluide ou quantique; c'est-à-dire que leurs propriétés macroscopiques se manifestent comme si les dimères Hedeux c'étaient des atomes individuels (et peut-être qu'ils le sont). Il manque de viscosité complète, car il n'y a pas de surface qui puisse arrêter un atome pendant son glissement ou son "escalade".
C'est pourquoi l'hélium II peut escalader les parois d'un récipient en verre en surmontant la force de gravité; quelle que soit leur hauteur, tant que la surface reste à la même température et ne se volatilise donc pas.
Pour cette raison, l'hélium liquide ne peut pas être stocké dans des récipients en verre, car il s'échapperait à la moindre fissure ou lacune; très similaire à la façon dont cela se passerait avec un gaz. Au lieu de cela, l'acier inoxydable est utilisé pour concevoir de tels récipients (réservoirs Dewars).
Cristaux
Même si la température tombait à 0 K (zéro absolu), la force de diffusion entre les atomes He ne serait pas assez forte pour les ordonner dans une structure cristalline. Pour que la solidification se produise, la pression doit s'élever à environ 25 atm; puis des cristaux d'hélium hexagonaux compacts (hcp) apparaissent.
Des études géophysiques montrent que cette structure hcp reste inchangée quelle que soit l'augmentation de la pression (jusqu'à l'ordre du gigapascals, GPa). Cependant, il y a une région étroite dans leur diagramme pression-température où ces cristaux de hcp subissent une transition vers une phase cubique centrée sur le corps (bcc)..
Où trouver et obtenir
Cosmos et roches

L'hélium est le deuxième élément le plus abondant de tout l'Univers, juste derrière l'hydrogène. Les étoiles produisent constamment des quantités incommensurables d'atomes d'hélium grâce à la fusion de deux noyaux d'hydrogène au cours du processus de nucléosynthèse..
De même, tout processus radioactif émettant des particules α est une source de production d'atomes d'hélium s'ils interagissent avec les électrons de l'environnement; par exemple, avec ceux d'un corps rocheux dans des gisements de minéraux radioactifs d'uranium et de thorium. Ces deux éléments subissent une désintégration radioactive, à commencer par l'uranium:
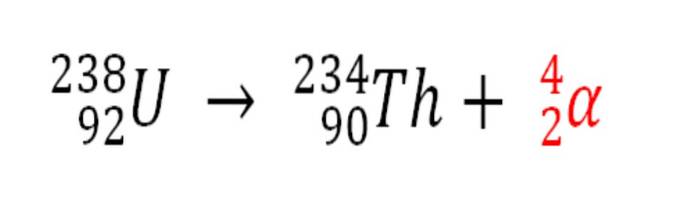
Par conséquent, dans les roches où ces minéraux radioactifs sont concentrés, les atomes d'hélium seront piégés, qui seront libérés une fois digérés dans des milieux acides..
Parmi certains de ces minéraux, on trouve la cleveite, la carnotite et l'uraninite, tous composés d'oxydes d'uranium (UOdeux ou U3OU ALORS8) et impuretés de thorium, de métaux lourds et de terres rares. L'hélium, irrigué par des canaux souterrains, peut finir par s'accumuler dans les réservoirs de gaz naturel, les sources minérales ou dans les fers météoriques.
On estime qu'une masse d'hélium équivalente à 3000 tonnes est produite annuellement dans la lithosphère, à partir de la désintégration radioactive de l'uranium et du thorium..
Air et mers
L'hélium n'est pas très soluble dans l'eau, donc tôt ou tard, il finit par remonter des profondeurs (quelle que soit son origine), jusqu'à ce qu'il traverse les couches de l'atmosphère et atteigne finalement l'espace extra-atmosphérique. Ses atomes sont si petits et légers que le champ gravitationnel de la Terre ne peut pas les retenir dans l'atmosphère..
En raison de ce qui précède, la concentration d'hélium à la fois dans l'air (5,2 ppm) et dans les mers (4 ppt) est très faible..
Si nous voulions l'extraire de l'un ou l'autre de ces deux milieux, la «meilleure» option serait l'air, qui devrait d'abord être soumis à une liquéfaction pour condenser tous ses gaz composants, tandis que l'hélium reste à l'état gazeux..
Cependant, il n'est pas pratique d'obtenir de l'hélium dans l'air, mais à partir de roches enrichies en minéraux radioactifs; ou mieux encore, à partir de réserves de gaz naturel, où l'hélium peut représenter jusqu'à 7% de sa masse totale.
Liquéfaction et distillation du gaz naturel
Au lieu de liquéfier l'air, il est plus facile et plus rentable d'utiliser du gaz naturel, dont la composition en hélium est sans doute beaucoup plus importante. Ainsi, la matière première par excellence (commerciale) pour l'obtention d'hélium est le gaz naturel, qui peut également être soumis à une distillation fractionnée..
Le produit final de la distillation est terminé par une purification avec du charbon actif, à travers lequel passe un hélium très pur. Et enfin, l'hélium est séparé du néon par un processus cryogénique où l'hélium liquide est utilisé..
Les isotopes
L'hélium se produit principalement dans la nature sous forme d'isotope 4Lui, dont le noyau nu est la fameuse particule α. Cet atome de 4Il a deux neutrons et deux protons. L'isotope est moins abondant 3Lui, qui n'a qu'un seul neutron. Le premier est plus lourd (a une masse atomique plus élevée) que le second.
Ainsi, la paire d'isotopes 3J'ai et 4Ce sont eux qui définissent les propriétés mesurables et ce que nous comprenons de l'hélium en tant qu'élément chimique. Depuis le 3Il est plus léger, on suppose que ses atomes ont une énergie cinétique plus élevée et que, par conséquent, ils ont besoin d'une température encore plus basse pour cohésion dans un superfluide.
le 3Il est considéré comme une espèce très rare ici sur Terre; cependant, sur les sols lunaires, il est plus abondant (environ 2000 fois plus). C'est pourquoi la Lune a fait l'objet de projets et d'histoires comme source possible de 3He, qui pourrait être utilisé comme combustible nucléaire pour le vaisseau spatial du futur.
Parmi les autres isotopes de l'hélium, on peut citer les suivants, avec leurs demi-vies respectives: 5J'ai (t1/2= 7,610−22 s), 6J'ai (t1/2= 0,8 s) et 8J'ai (t1/2= 0,119 s).
Des risques
L'hélium est un gaz inerte et ne participe donc à aucune des réactions qui se produisent dans notre corps..
Ses atomes entrent et sortent pratiquement exhalés sans que leurs interactions avec les biomolécules produisent un effet ultérieur; à l'exception du son émis par les cordes vocales, qui deviennent plus aiguës et ont une fréquence plus élevée.
Les personnes qui inhalent l'hélium d'un ballon (avec modération) parlent d'une voix aiguë, semblable à celle d'un écureuil (ou d'un canard).
Le problème est que s'il inhale une quantité inappropriée d'hélium, il court le risque de suffocation, puisque ses atomes déplacent les molécules d'oxygène; et par conséquent, vous ne pourrez pas respirer tant que vous n'aurez pas expiré tout cet hélium, qui à son tour, en raison de sa pression, peut déchirer le tissu pulmonaire ou provoquer un barotraumatisme.
Des cas de personnes décédées suite à l'inhalation d'hélium ont été rapportés en raison de ce qui vient d'être expliqué.
En revanche, s'il ne représente pas de risque d'incendie compte tenu de son manque de réactivité vis-à-vis de l'oxygène (ou d'une autre substance), s'il est stocké sous haute pression et qu'il s'échappe, sa fuite peut être physiquement dangereuse..
Applications
Les propriétés physiques et chimiques de l'hélium en font non seulement un gaz spécial, mais également une substance très utile pour les applications nécessitant des températures extrêmement basses. Dans cette section, certaines de ces applications ou utilisations seront abordées..
Systèmes de pression et de purge
Dans certains systèmes, il est nécessaire d'augmenter la pression (pressuriser), et pour cela un gaz doit être injecté ou fourni qui n'interagit avec aucun de ses composants; par exemple avec des réactifs ou des surfaces sensibles aux réactions indésirables.
Ainsi, la pression peut être augmentée avec des volumes d'hélium, dont l'inertie chimique le rend idéal à cet effet. L'atmosphère inerte qu'elle facilite dépasse dans certains cas celle de l'azote.
Pour le processus inverse, c'est-à-dire la purge, l'hélium est également utilisé en raison de sa capacité à transporter tout l'oxygène, les vapeurs d'eau ou tout autre gaz, dont vous souhaitez éliminer la présence. De cette manière, la pression du système est réduite une fois l'hélium vidé..
Détections de fuites
L'hélium peut fuir à travers la moindre fissure, il sert donc également à détecter les fuites dans les tuyaux, les conteneurs à vide poussé ou les réservoirs cryogéniques.
Parfois, la détection peut être effectuée visuellement ou au toucher; cependant, la plupart du temps, un détecteur est ce qui «donne» le signal de l'endroit et de la quantité d'hélium qui s'échappe du système en cours d'inspection..
Gaz vecteur
Les atomes d'hélium, comme mentionné pour les systèmes de purge, peuvent emporter avec eux, en fonction de leur pression, des molécules plus lourdes. Par exemple, ce principe est utilisé quotidiennement dans l'analyse par chromatographie en phase gazeuse, car il peut entraîner l'échantillon atomisé le long de la colonne, où il interagit avec la phase stationnaire..
Ballons et dirigeables

En raison de sa faible densité par rapport à l'air et, encore une fois, de son manque de réactivité avec l'oxygène, il a été utilisé pour gonfler des ballons lors de fêtes d'enfants (mélangé à de l'oxygène pour que personne ne s'étouffe en le respirant), et des dirigeables (image du haut), sans représenter un risque d'incendie.
Plongée

Lorsque les plongeurs descendent à de plus grandes profondeurs, ils ont du mal à respirer en raison de la forte pression exercée par l'eau. C'est pourquoi de l'hélium est ajouté à leurs réservoirs d'oxygène pour diminuer la densité du gaz que les plongeurs respirent et expirent, et ainsi, il peut être expiré avec moins de travail..
Soudures à l'arc
Dans le processus de soudage, l'arc électrique fournit suffisamment de chaleur pour que les deux métaux se rejoignent. Si cela est fait sous une atmosphère d'hélium, le métal incandescent ne réagira pas avec l'oxygène de l'air pour devenir son oxyde respectif; donc l'hélium empêche que cela se produise.
Supraconducteurs
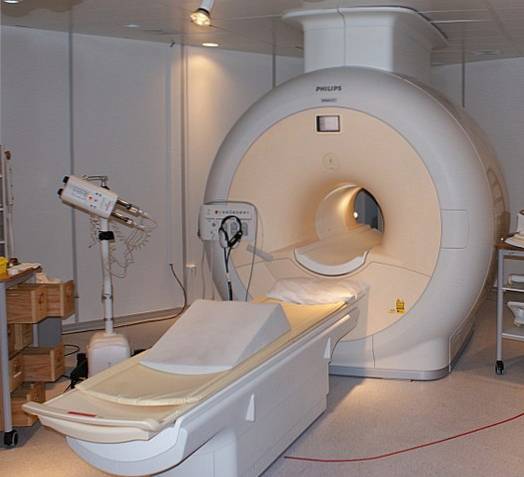
L'hélium liquide est si froid qu'il peut geler les métaux en supraconducteurs. Grâce à cela, il a été possible de fabriquer des aimants très puissants, qui, refroidis à l'hélium liquide, ont été utilisés dans des scanners d'images ou des spectromètres à résonance magnétique nucléaire..
Les références
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Andy Extance. (17 avril 2019). Ion hydrure d'hélium détecté dans l'espace pour la première fois: preuve trouvée pour une chimie insaisissable dès les premières minutes de l'univers. Récupéré de: chemistryworld.com
- Peter Wothers. (19 août 2009). Hélium. La chimie dans son élément. Récupéré de: chemistryworld.com
- Wikipédia. (2019). Hélium. Récupéré de: en.wikipedia.org
- Mao, H. K., Wu, Y., Jephcoat, A. P., Hemley, R. J., Bell, P. M. et Bassett, W. A. (1988). Structure cristalline et densité de l'hélium jusqu'à 232 Kbar. Récupéré de: articles.adsabs.harvard.edu
- Centre national d'information sur la biotechnologie. (2019). Hélium. Base de données PubChem. CID = 23987. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Mary-Ann Muffoletto. (6 février 2017). De haut en bas: les chimistes disent «oui», l'hélium peut former des composés. Université d'État de l'Utah. Récupéré de: phys.org
- Steve Gagnon. (s.f.). Isotopes de l'élément hélium. Jefferson Lab. Récupéré de: education.jlab.org
- Advameg, Inc. (2019). Hélium. Récupéré de: chemistryexplained.com



Personne n'a encore commenté ce post.