
Structure, propriétés et utilisations de l'heptane (C7H16)
le heptane est un composé organique dont la formule chimique est C7H16 et comprend neuf isomères structuraux, dont le plus connu est linéaire. C'est un hydrocarbure, plus précisément un alcane ou une paraffine, que l'on retrouve dans la plupart des laboratoires de chimie organique, qu'ils soient d'enseignement ou de recherche..
Contrairement à d'autres solvants paraffiniques, l'heptane a une volatilité plus faible, ce qui le rend relativement plus sûr à utiliser; à condition qu'il n'y ait pas de source de chaleur autour de vos vapeurs et que vous travaillez à l'intérieur d'une hotte aspirante. Hormis son inflammabilité, c'est un composé suffisamment inerte pour servir de milieu aux réactions organiques..
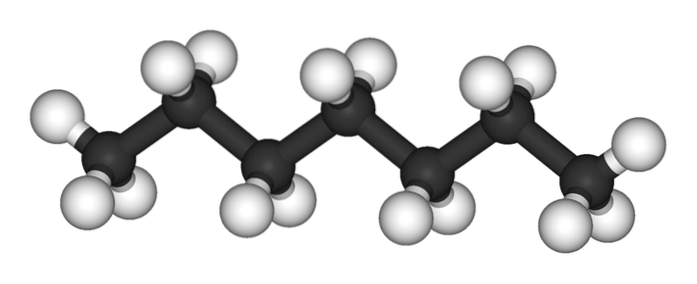
L'image du haut montre la structure du n-heptane, l'isomère linéaire de tous les heptanes. Puisqu'il s'agit de l'isomère le plus courant et le plus commercialement intéressant, ainsi que le plus facile à synthétiser, on a tendance à comprendre que le terme `` heptane '' se réfère exclusivement à n-heptane; sauf indication contraire.
Cependant, les bouteilles de ce composé liquide précisent qu'il contient n-heptane. Ils doivent être découverts à l'intérieur d'une hotte aspirante et les mesures doivent être prises avec soin.
C'est un excellent solvant pour les graisses et les huiles, c'est pourquoi il est fréquemment utilisé lors des extractions d'essences végétales ou d'autres produits naturels..
Index des articles
- 1 Structure
- 1.1 n-heptane et ses interactions intermoléculaires
- 1.2 Isomères
- 2 Propriétés de l'heptane
- 2.1 Apparence physique
- 2.2 Masse molaire
- 2.3 Point de fusion
- 2.4 Point d'ébullition
- 2.5 Pression de vapeur
- 2.6 Densité
- 2.7 Solubilité dans l'eau
- 2.8 Solubilité dans d'autres solvants
- 2.9 Indice de réfraction (nD)
- 2.10 Viscosité
- 2.11 Capacité calorifique
- 2.12 Point d'éclair
- 2.13 Température d'auto-inflammation
- 2.14 Tension superficielle
- 2.15 Chaleur de combustion
- 2.16 Réactivité
- 3 utilisations
- 3.1 Solvant et milieu réactionnel
- 3.2 Agent précipitant
- 3,3 octane
- 4 Références
Structure
n-heptane et ses interactions intermoléculaires
Comme on peut le voir sur la première image, la molécule de n-L'heptane est linéaire et, en raison de l'hybridation chimique de ses atomes de carbone, la chaîne prend une forme en zigzag. Cette molécule est dynamique, car ses liaisons C-C peuvent tourner, provoquant une légère flexion de la chaîne à des angles différents. Cela contribue à leurs interactions intermoléculaires..
le n-l'heptane est une molécule apolaire hydrophobe et ses interactions sont donc basées sur les forces de dispersion de Londres; Ce sont ceux qui dépendent de la masse moléculaire du composé et de sa surface de contact. Deux molécules de n-l’heptane s’approche de telle sorte qu’ils «calent» leurs chaînes les unes sur les autres.
Ces interactions sont suffisamment efficaces pour garder les molécules de n-Heptane cohésif dans un liquide qui bout à 98 ºC.
Isomères
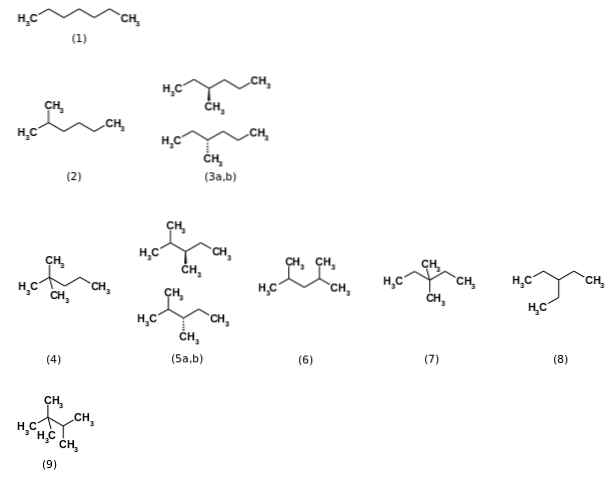
Au début, on a dit que la formule C7H16 représentait un total de neuf isomères structuraux, étant le n-heptane le plus pertinent (1). Les huit autres isomères sont présentés dans l'image ci-dessus. Notez en un coup d'œil que certains sont plus ramifiés que d'autres. De gauche à droite, en partant du haut, nous avons:
(2): 2-méthylhexane
(3): 3-méthylhexane, qui consiste en une paire d'énantiomères (a et b)
(4): 2,2-diméthylpentane, également appelé néoheptane
(5): 2,3-diméthylpentane, à nouveau avec une paire d'énantiomères
(6): 2,4-diméthylpentane
(7): 3,3-diméthylpentane
(8): 3-éthylpentane
(9): 2,2,3-triméthylbutane.
Chacun de ces isomères a des propriétés et des applications indépendantes de la n-heptane, principalement réservé aux zones de synthèse organique.
Propriétés de l'heptane
Aspect physique
Liquide incolore avec une odeur d'essence.
Masse molaire
100,205 g / mol
Point de fusion
-90,549 ºC, devenant un cristal moléculaire.
Point d'ébullition
98,38 ºC.
La pression de vapeur
52,60 atm à 20 ° C Notez à quel point sa pression de vapeur est élevée, bien qu'elle soit moins volatile que d'autres solvants paraffiniques, tels que l'hexane et le pentane..
Densité
0,6795 g / cm3. En revanche, les vapeurs d'heptane sont 3,45 fois plus denses que l'air, ce qui signifie que ses vapeurs s'attarderont dans les espaces où une petite partie de son liquide se répand..
Solubilité dans l'eau
L'heptane, étant un composé hydrophobe, peut à peine se dissoudre dans l'eau pour produire une solution avec une concentration de 0,0003% à une température de 20 ºC..
Solubilité dans d'autres solvants
L'heptane est miscible avec le tétrachlorure de carbone, l'éthanol, l'acétone, le pétrole léger et le chloroforme..
Indice de réfraction (nré)
1,3855.
Viscosité
0,389 mPa s
Capacité thermique
224,64 J / K mol
point d'allumage
-4 ºC
La température d'auto-inflammation
223 ºC
Tension superficielle
19,66 mN / m à 25 ºC
Chaleur de combustion
4817 kJ / mol.
Réactivité
Les vapeurs d'heptane à proximité d'une source de chaleur (une flamme) réagissent de manière exothermique et vigoureuse avec l'oxygène de l'air:
C7H16 + 11Odeux => 7COdeux + 8HdeuxOU ALORS
Cependant, en dehors de la réaction de combustion, l'heptane est un liquide assez stable. Son manque de réactivité est dû au fait que ses liaisons C-H sont difficiles à rompre, il n'est donc pas sensible aux substitutions. De même, il n'est pas très sensible aux agents oxydants forts, tant qu'il n'y a pas de feu à proximité..
Le plus grand danger de l'heptane est sa volatilité et son inflammabilité élevées, il y a donc un risque d'incendie s'il est renversé dans des endroits chauds.
Applications
Solvant et milieu réactionnel

Le caractère hydrophobe de l'heptane en fait un excellent solvant pour dissoudre les huiles et les graisses. Dans cet aspect, il a été utilisé comme dégraissant. Cependant, sa plus grande application réside dans son utilisation comme solvant d'extraction, car il dissout les composants lipidiques, ainsi que les autres composés organiques d'un échantillon..
Par exemple, si vous vouliez extraire tous les composants du café moulu, il serait macéré dans de l'heptane au lieu de l'eau. Cette méthode et ses variantes ont été mises en œuvre avec tous les types de semences, grâce auxquelles des essences végétales et d'autres produits naturels ont été obtenus..
L'heptane, qui est naturellement incolore, va teinter la couleur de l'huile extraite. Ensuite, il est mis en rotation pour avoir enfin un volume d'huile le plus pur possible..
D'autre part, la faible réactivité de l'heptane lui permet également d'être une option lorsque l'on considère un milieu réactionnel pour effectuer une synthèse. Étant un bon solvant pour les composés organiques, il garantit que les réactifs restent en solution et interagissent correctement les uns avec les autres tout en réagissant.
Agent précipitant
En chimie du pétrole, il est courant de précipiter les asphaltènes à partir d'un échantillon brut en ajoutant de l'heptane. Cette méthode permet d'étudier la stabilité de différents pétroles bruts et de déterminer dans quelle mesure leur teneur en asphaltène est susceptible de précipiter et de causer toute une série de problèmes pour l'industrie pétrolière..
Octane
L'heptane a été utilisé comme combustible en raison de la grande quantité de chaleur qu'il dégage lorsqu'il brûle. Cependant, en ce qui concerne les moteurs de voitures, il serait préjudiciable à leurs performances s'il était utilisé à l'état pur. Parce qu'il brûle de manière très explosive, il sert à définir 0 sur l'échelle d'octane de l'essence..
L'essence contient un pourcentage élevé d'heptane et d'autres hydrocarbures pour amener l'indice d'octane à des valeurs connues (91, 95, 87, 89, etc.).
Les références
- Morrison, R. T. et Boyd, R, N. (1987). Chimie organique. 5e édition. Éditorial Addison-Wesley Interamericana.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organique. (10e édition.). Wiley plus.
- Wikipédia. (2020). Heptane. Récupéré de: en.wikipedia.org
- Centre national d'information sur la biotechnologie. (2020). Base de données Heptane PubChem. CID = 8900. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Elsevier B.V. (2020). Heptanes ScienceDirect. Récupéré de: sciencedirect.com
- Bell Chem Corp. (7 septembre 2018). Utilisations industrielles de l'heptane. Récupéré de: bellchem.com
- Andrea Kropp. (2020). Heptane: structure, utilisations et formule. Étude. Récupéré de: study.com


Personne n'a encore commenté ce post.