
Structure du benzoate de potassium, propriétés, production, utilisations

le benzoate de potassium est un composé organique formé par un ion potassium K+ et un ion benzoate C6H5ROUCOULER-. Sa formule chimique est C6H5COOK ou formule condensée C7H5KOdeux. C'est un solide cristallin blanc. Il est hygroscopique, ce qui signifie qu'il absorbe l'eau de l'air.
Les solutions aqueuses de benzoate de potassium sont légèrement alcalines. En milieu acide, l'ion benzoate (C6H5ROUCOULER-) a tendance à prendre un proton et à se transformer en acide benzoïque (C6H5COOH).

Le benzoate de potassium est utilisé comme conservateur alimentaire, en particulier lorsque l'on souhaite que ceux-ci soient sans sodium (Na). Empêche la détérioration des aliments due aux micro-organismes.
Il est utilisé dans la charcuterie, les boissons gazeuses transformées et les produits de boulangerie, entre autres aliments. Son action conservatrice est probablement due à l'acide benzoïque (C6H5COOH) qui se forme à un pH bas, ce qui empêche la reproduction de champignons et de bactéries.
Bien que le benzoate de potassium soit approuvé par les organismes de santé, il est conseillé de ne pas abuser de son utilisation, car il a été constaté qu'il peut affecter les fœtus de souris.
Index des articles
- 1 Structure
- 2 Nomenclature
- 3 propriétés
- 3.1 État physique
- 3.2 Poids moléculaire
- 3.3 Solubilité
- 3,4 pH
- 3.5 Propriétés chimiques
- 4 Obtention
- 5 utilisations
- 5.1 Dans l'industrie des aliments transformés
- 5.2 Contre les champignons
- 5.3 Contre les bactéries
- 5.4 Dans diverses applications
- 5.5 Effets négatifs de l'ingestion d'aliments avec du benzoate de potassium
- 6 Références
Structure
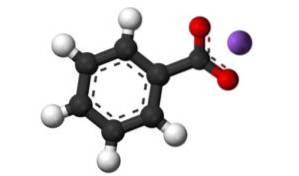
Le benzoate de potassium est un sel organique, c'est-à-dire un sel d'un acide carboxylique, car c'est le sel de potassium de l'acide benzoïque. Il est composé d'un cation potassium K + et d'un anion benzoate C6H5ROUCOULER-.
Benzoate anion C6H5ROUCOULER- se compose d'un cycle benzénique C6H5- et un groupe carboxylate -COO-.
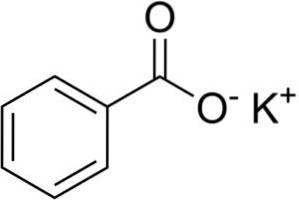
La liaison entre ces deux ions est une forte liaison électrostatique qui les maintient dans le réseau cristallin..
Nomenclature
- Benzoate de potassium
- Sel de potassium d'acide benzoïque
Propriétés
État physique
Cristallin blanc solide.
Poids moléculaire
160,212 g / mol
Solubilité
Soluble dans l'eau.
pH
Les solutions aqueuses de benzoate de potassium sont légèrement basiques.
Propriétés chimiques
Il est hygroscopique, c'est-à-dire qu'il s'agit d'un solide qui absorbe facilement l'eau de l'environnement.
L'union entre l'ion potassium K+ et l'ion benzoate C6H5ROUCOULER- comme dans la plupart des composés ioniques, il ne peut être surmonté que par une température élevée ou par un solvant très polaire tel que l'eau.
Benzoate anion C6H5ROUCOULER- il est modérément basique, avec une tendance appréciable à se combiner avec des protons. Réagit avec l'eau en prenant un proton H+ pour former de l'acide benzoïque (C6H5COOH) et cela conduit à une augmentation de la concentration des ions OH-.
C6H5ROUCOULER- + HdeuxO ⇔ C6H5COOH + OH-
Pour cette raison, les solutions aqueuses de benzoate de potassium sont légèrement alcalines..
Obtention
Pour préparer le benzoate de potassium, l'acide benzoïque (C6H5COOH) avec du carbonate de potassium (KdeuxCO3) dans un volume minimum d'eau pour obtenir une solution limpide à partir de laquelle le sel cristallise.
2 C6H5COOH + KdeuxCO3 → 2 C6H5ROUCOULER-K+ + HdeuxO + COdeux↑
Ensuite, le sel de benzoate de potassium cristallisé est lavé plusieurs fois avec de l'éther et séché.
Applications
Dans l'industrie agro-alimentaire
Le benzoate de potassium est largement utilisé comme agent antimicrobien pour la conservation des boissons, des dérivés de fruits, des produits de boulangerie et d'autres aliments.

C'est un conservateur alimentaire, capable d'inhiber, de ralentir ou de ralentir le processus de fermentation, d'acidification ou de détérioration des aliments en raison de certains champignons et bactéries..
Selon l'Agence de protection de l'environnement ou EPA Agence de Protection de l'Environnement) le benzoate de potassium a été vérifié comme un composé peu préoccupant pour la santé humaine.
Contre les champignons
C'est un agent antifongique, car il peut les détruire en supprimant leur capacité à se développer ou à se reproduire. Ce n'est pas un fongicide pour les tissus du corps des animaux ou des humains, mais un inhibiteur qui ralentit ou ralentit la propagation des champignons dans les aliments ou les boissons.
Certains types de moisissures produisent des substances appelées aflatoxines, qui constituent une menace pour les humains et les animaux car elles sont toxiques, peuvent provoquer des cancers et des mutations..
La plupart des moisissures sont inhibées à des concentrations de 0,05 à 0,10% de benzoate de potassium. La performance de cela dépend du pH, car à un pH plus bas, il est plus efficace comme antifongique.

En effet, l'action antifongique réside en fait dans l'acide benzoïque C6H5COOH, qui est l'acide conjugué du benzoate de potassium. Cet acide se forme à pH bas, c'est-à-dire en présence d'une grande quantité d'ions hydrogène H+:
Benzoate de potassium + ions hydrogène → acide benzoïque + ions potassium
C6H5CUISINER + H+ → C6H5COOH + K+
Selon certains chercheurs, son efficacité est en partie due à la solubilité de l'acide benzoïque dans la membrane cellulaire du microorganisme. Ce type d'acide augmente le flux de protons à travers ladite membrane..
Cela provoque la perturbation ou la désorganisation de certaines fonctions de la cellule fongique..
Contre les bactéries
C'est un agent qui agit contre certaines bactéries. Il est ajouté à des aliments tels que les saucisses transformées, les jambons transformés (prêts à manger) et certaines boissons.
Il a été testé contre Listeria monocytogenes, une bactérie qui peut tuer les humains qui mangent des aliments contaminés. Il produit de la fièvre, des vomissements et de la diarrhée, entre autres symptômes.
Il a été constaté que les aliments traités au benzoate de potassium et contaminés par le benzoate de potassium Listeria doivent être conservés à des températures inférieures à -2,2 ° C afin que lesdites bactéries ne se reproduisent pas.

D'autre part, l'utilisation du rayonnement électronique a été tentée pour intensifier l'effet du benzoate de potassium contre les bactéries, mais il a été déterminé que du benzène C est produit.6H6 qui est un composé toxique.
Par conséquent, bien que les aliments contiennent du benzoate de potassium, il est recommandé de les cuire de préférence à des températures élevées avant d'être consommés, afin d'éliminer tout type de danger dérivé de la présence de bactéries pathogènes..
Dans diverses applications
Selon les sources consultées, le benzoate de potassium est également utilisé dans les adhésifs et les liants pour une variété d'utilisations. Il est ajouté aux cigarettes et au tabac ou est lié à la fabrication de ceux-ci.
Il est utilisé dans les produits de soins personnels tels que les cosmétiques, les shampoings, les parfums, les savons, les lotions, etc. Fait également partie des peintures et revêtements.
Effets négatifs de l'ingestion d'aliments avec du benzoate de potassium
Certains chercheurs ont découvert que le benzoate de potassium avait des effets nocifs sur les fœtus de souris.
Bien qu'aucun effet n'ait été observé chez les souris adultes exposées au benzoate de potassium, des malformations ont été observées dans les yeux des fœtus et une diminution marquée du poids et de la longueur des petits corps des fœtus de souris..
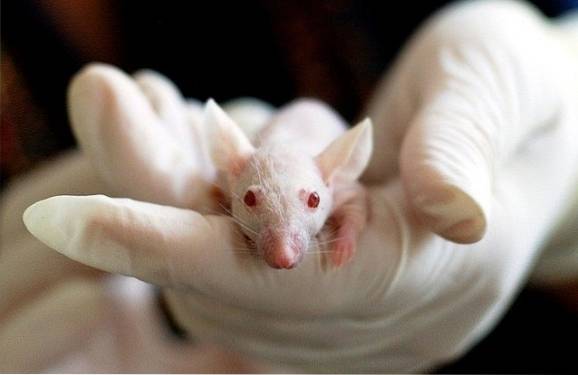
Cela signifie que les fœtus sont plus sensibles au benzoate de potassium que les souris adultes..
Les références
- Mandal, P.K. et coll. (1978). Comportement de viscosité de l'acide benzoïque et de l'ion benzoate en solution aqueuse. Journal of Solution Chemistry, volume 7, n ° 1, 1978. Récupéré de link.springer.com.
- Rusul, G. et Marth, E.H. (1987). Croissance et production d'aflatoxines par Aspergillus parasiticus NRRL 2999 en présence de bnezoate de potassium ou de sorbate de potassium et à différentes valeurs de pH initial. J Food Prot.1987; 50 (10): 820-825. Récupéré de ncbi.nlm.nih.gov.
- Lu, Z. et coll. (2005). Effets inhibiteurs des sels d'acides organiques pour le contrôle des Listeria monocytogenes sur Frankfurters. J Food Prot.2005; 68 (3): 499-506. Récupéré de ncbi.nlm.nih.gov.
- Zhu, M.J. et coll. (2005). Impact des ingrédients antimicrobiens et de l'irradiation sur la survie de Listeria monocytogenes et la qualité du jambon de dinde prêt à manger. Poult Sci.2005; 84 (4): 613-20. Récupéré de ncbi.nlm.nih.gov.
- NOUS. Bibliothèque nationale de médecine. (2019). Benzoate de potassium. Récupéré de pubchem.ncbi.nlm.nih.gov.
- Afshar, M. et coll. (2013). Effets tératogènes de la consommation à long terme de benzoate de potassium sur le développement des yeux chez les souris fœtales Balb / c. Iran J Basic Med Sci.2013; 16 (4): 584-589. Récupéré de ncbi.nlm.nih.gov.
- Lide, D.R. (éditeur) (2003). CRC Handbook of Chemistry and Physics. 85e Presse CRC.
- Morrison et R.T. et Boyd, R.N. (2002). Chimie organique. 6e édition. Prentice Hall.


Personne n'a encore commenté ce post.