
Concept, processus et exemples de sublimation progressive

La sublimation progressive Il s'agit d'un processus thermodynamique dans lequel un changement d'état endothermique se produit directement d'un solide à un gaz, sans formation préalable du liquide. Le comportement du solide dans des conditions normales est de se réchauffer et de fondre; c'est-à-dire fusionner. Pendant ce temps, lors de la sublimation, le solide commence à fumer directement, sans l'apparition préalable de gouttes indiquant sa fusion..
Ce qui est décrit dans le paragraphe ci-dessus est représenté dans l'image ci-dessus. Supposons un mélange orange solide (à gauche), qui commence à chauffer. Le mélange se compose de deux composants ou solides: l'un jaune et l'autre rouge, dont la combinaison se traduit par la couleur orange..
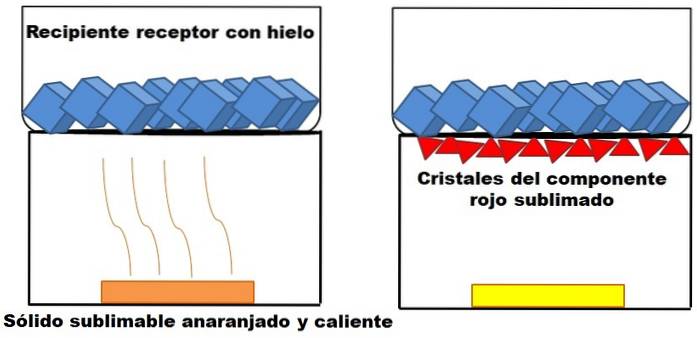
Le solide rouge se sublime, puisqu'un liquide n'en est pas formé mais finit par se déposer (triangles rouges) à la base du récipient supérieur; celui qui contient des glaçons, et offre donc une surface froide. Pendant ce temps, le solide jaune reste inchangé par la chaleur (rectangle jaune).
Les triangles ou cristaux rouges se déposent grâce à la surface froide du récipient récepteur (à droite), qui absorbe leur température; Et même s'il n'est pas affiché, la taille de vos glaçons devrait diminuer en raison de l'absorption de chaleur. Le solide jaune n'est pas sublimable, et si vous continuez à le chauffer tôt ou tard, il fondra.
Index des articles
- 1 Concept de sublimation progressive
- 1.1 Processus
- 1.2 De la structure solide au désordre gazeux
- 1.3 Diagramme de phase et point triple
- 1.4 Conditions
- 2 exemples
- 2.1 Purification des solides
- 2.2 Synthèse cristalline
- 3 Références
Concept de sublimation progressive
Traiter
On a déjà dit que la sublimation est un changement d'état endothermique, car pour qu'elle se produise, il doit y avoir absorption de chaleur. Si le solide absorbe de la chaleur, son énergie augmentera, de sorte que ses particules vibreront également à des fréquences plus élevées..
Lorsque ces vibrations deviennent très fortes, elles finissent par affecter les interactions intermoléculaires (pas les liaisons covalentes); et par conséquent, tôt ou tard, les particules prendront plus de distances les unes des autres, jusqu'à ce qu'elles parviennent à s'écouler et à se déplacer plus librement à travers les régions de l'espace.
Dans certains solides, les vibrations sont si fortes que certaines particules "jaillissent" de la structure au lieu de s'agglomérer en groupes mobiles qui définissent une gouttelette. Ces particules s'échappent et forment la première "bulle", qui formerait plutôt les premières vapeurs du solide sublimé..
On ne parle donc pas d'un point de fusion, mais d'un point de sublimation. Bien que les deux dépendent de la pression régnant sur le solide, le point de sublimation l'est davantage; par conséquent, sa température varie remarquablement avec les changements de pression (tout comme le point d'ébullition).
De la structure solide au désordre gazeux
En sublimation, on dit aussi qu'il y a une augmentation de l'entropie du système. Les états énergétiques des particules vont d'être limités par leurs positions fixes dans la structure solide, à s'homogénéiser dans leurs directions capricieuses et chaotiques à l'état gazeux, plus uniformes, où elles acquièrent finalement une énergie cinétique moyenne..
Diagramme de phase et point triple
Le point de sublimation dépend de la pression; car sinon, les particules solides absorberaient la chaleur non pas pour se propager dans l'espace à l'extérieur du solide, mais pour former des gouttelettes. Ça ne se sublimerait pas, mais ça fondrait ou fondrait, comme c'est le plus habituel.
Plus la pression externe est élevée, moins la sublimation est probable, car le solide est forcé de fondre.
Mais quels solides sont sublimables et lesquels ne le sont pas? La réponse réside dans vos diagrammes de phase P vs T, comme celui illustré ci-dessous:
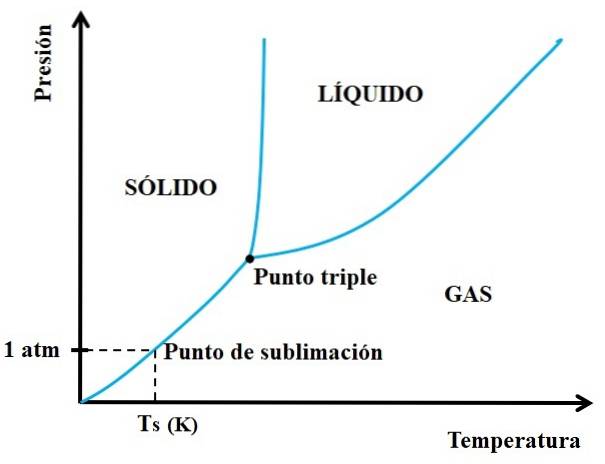
Il faut d'abord regarder le point triple et passer par la partie inférieure: celle qui sépare les états solide et gazeux. Notez que dans la région du solide, il doit y avoir une baisse de pression pour que la sublimation se produise (pas nécessairement à 1 atm, notre pression atmosphérique). A 1 atm, la substance hypothétique se sublimera à une température Ts exprimée en K.
Plus la section ou la courbe est longue et horizontale en dessous du point triple, plus la capacité du solide à se sublimer à différentes températures est grande; mais s'il est bien en dessous de 1 atm, alors des vides élevés seront nécessaires pour réaliser la sublimation, de telle sorte que les pressions soient abaissées (0,0001 atm, par exemple).
termes
Si le point triple est des milliers de fois inférieur à la pression atmosphérique, le solide ne se sublimera jamais même lors de l'application de l'ultra-vide (sans parler de sa susceptibilité à la décomposition par l'action de la chaleur).
Si ce n'est pas le cas, les sublimations sont effectuées en chauffant modérément, et en soumettant le solide à un vide pour que ses particules s'échappent plus facilement, sans qu'il soit nécessaire qu'elles absorbent autant de chaleur..
La sublimation devient très importante lorsqu'il s'agit notamment de solides avec une pression de vapeur élevée; c'est-à-dire la pression à l'intérieur, un reflet de l'efficacité de leurs interactions. Plus sa pression de vapeur est élevée, plus elle est parfumée et plus elle est sublimable..
Exemples
Purification des solides
L'image du solide orange et de sa composante rougeâtre sublimable est un exemple de ce que représente la sublimation en ce qui concerne la purification des solides. Les triangles rouges peuvent être re-sublimés au besoin jusqu'à ce qu'une grande pureté soit garantie.
Cette technique est principalement utilisée avec des solides parfumés. Par exemple: camphre, caféine, benjoin et menthol.
Parmi les autres solides pouvant être sublimés, nous avons: l'iode, la glace (à haute altitude), la théobromine (du chocolat), la saccharine, la morphine et d'autres médicaments, les bases azotées et l'anthracène.
Synthèse cristalline
Revenant aux triangles rouges, la sublimation offre une alternative à la cristallisation conventionnelle; Les cristaux ne seront plus synthétisés à partir d'une solution, mais par le dépôt le plus contrôlé possible de vapeurs sur une surface froide, où il peut commodément y avoir des graines cristallines pour favoriser une morphologie spécifique.
Dites, si vous avez des carrés rouges, la croissance des cristaux conservera cette géométrie et ils ne devraient pas devenir triangulaires. Les carrés rouges se développeront progressivement au fur et à mesure de la sublimation. Cependant, il s'agit d'un complexe complexe sur le plan opérationnel et moléculaire, dans lequel de nombreuses variables sont impliquées..
Des exemples de cristaux synthétisés par sublimation sont: le carbure de silicium (SiC), le graphite, l'arsenic, le sélénium, le phosphore, le nitrure d'aluminium (AlN), le sulfure de cadmium (CdS), le séléniure de zinc (ZnSe), l'iodure de mercure (HgI).deux), graphène, entre autres.
Notez qu'il s'agit en réalité de deux phénomènes entrelacés: la sublimation progressive et le dépôt (ou sublimation inverse); la vapeur migre du solide vers des régions ou des surfaces plus froides, se déposant finalement sous forme de cristaux.
Les références
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE.
- Wikipédia. (2019). Sublimation (transition de phase). Récupéré de: en.wikipedia.org
- Jones, Andrew Zimmerman. (27 janvier 2019). Sublimation. Récupéré de: thinkco.com
- Sheila Morrissey. (2019). Qu'est-ce que la sublimation en chimie? - Définition, processus et exemples. Étude. Récupéré de: study.com
- Elsevier B.V. (2019). Méthode de sublimation. ScienceDirect. Récupéré de: sciencedirect.com


Personne n'a encore commenté ce post.