
Structure, propriétés et utilisations de l'acide chlorhydrique (HCl)

le acide chlorhydrique (HCl) ou acide muriatique est un composé inorganique formé par la dissolution dans l'eau du chlorure d'hydrogène, à l'origine de l'ion hydronium (H3OU ALORS+) et l'ion chlorure (Cl-). Plus précisément, c'est l'hydracide de l'halogène chlore avec l'hydrogène.
Le HCl est un acide fort qui s'ionise complètement dans l'eau et ses produits d'ionisation sont stables. L'ionisation complète de HCl est corroborée par le fait que le pH d'une solution de HCl 0,1 M est de 1.

La principale méthode de production industrielle de HCl est la chloration de composés organiques pour produire, par exemple, du dichlorométhane, du trichloréthylène, du perchloréthylène ou du chlorure de vinyle. Le HCl est un sous-produit de la réaction de chloration.
Il est utilisé dans le titrage de bases dans de nombreuses réactions chimiques, dans la digestion chimique de composés organiques, etc..
Les vapeurs d'acide chlorhydrique (chlorure d'hydrogène) peuvent blesser gravement les yeux. De plus, ils peuvent provoquer des irritations et des problèmes graves des voies respiratoires.
La lumière gastrique a un pH acide (1-3) avec une concentration élevée de HCl. La présence d'acide favorise la stérilisation du contenu gastrique, inactivant de nombreuses bactéries présentes dans les aliments. Cela expliquerait la gastro-entérite associée à l'état d'achlorhydrie.
De plus, HCl facilite la digestion des protéines en activant l'enzyme protéolytique pepsine..
Il est utilisé dans le nettoyage des piscines, généralement un détergent commun suffit mais il y a des taches qui adhèrent entre les carreaux, nécessitant dans ces cas l'utilisation d'acide chlorhydrique.
Il est utilisé dans le contrôle du pH dans les produits pharmaceutiques, les aliments et l'eau potable. Il est également utilisé dans la neutralisation des flux de déchets contenant des matières alcalines..
L'acide chlorhydrique est utilisé dans la régénération des résines échangeuses d'ions, utilisé pour séquestrer les ions métalliques ou d'autres types d'ions dans l'industrie, dans les laboratoires de recherche et dans la purification de l'eau potable..
D'autre part, on peut également faire remarquer que le chlorure d'hydrogène, un composé gazeux, est une molécule diatomique et les atomes qui la forment sont reliés par une liaison covalente. Pendant ce temps, l'acide chlorhydrique est un composé ionique qui, en solution aqueuse, se dissocie en H+ et Cl-. L'interaction entre ces ions est électrostatique..
Index des articles
- 1 Structure chimique
- 2 Formation
- 3 Où est-il situé?
- 3.1 Gastrine
- 3.2 Histamine
- 3.3 Acétylcholine
- 3.4 Autres sources de HCl biologique
- 4 Propriétés physiques et chimiques
- 4.1 Poids moléculaire
- 4.2 Couleur
- 4.3 Odeur
- 4.4 Saveur
- 4.5 Point d'ébullition
- 4.6 Point de fusion
- 4.7 Solubilité dans l'eau
- 4.8 Solubilité dans le méthanol
- 4.9 Solubilité dans l'éthanol
- 4.10 Solubilité dans l'éther
- 4.11 Densité
- 4.12 Densité du gaz
- 4.13 Densité de vapeur
- 4.14 Pression de vapeur
- 4.15 Stabilité
- 4.16 Auto-inflammation
- 4.17 Décomposition
- 4.18 Corrosivité
- 4.19 Tension superficielle
- 4.20 Polymérisation
- 5 utilisations
- 5.1 Industriel et domestique
- 5.2 Synthèse et réactions chimiques
- 6 Risques et toxicité
- 7 Prévention des dommages causés par l'acide chlorhydrique
- 8 Références
Structure chimique
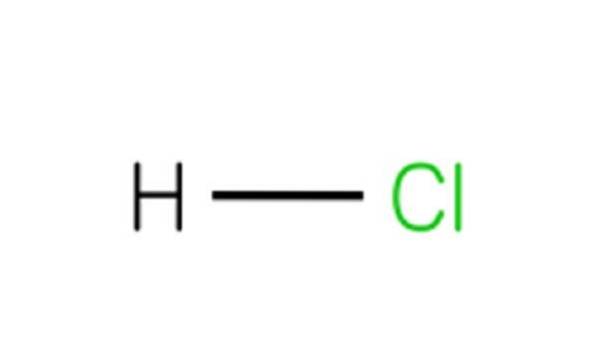
Chaque molécule de HCl est composée d'un atome d'hydrogène et d'un atome de chlore. Bien qu'à température ambiante, le HCl soit toxique et un gaz incolore, s'il se dissout dans l'eau, il donne de l'acide chlorhydrique..
Formation

-Il peut être produit par électrolyse de NaCl (chlorure de sodium) qui provient de Hdeux (g), Cldeux (g), 2Na (ac) et OH- (ac). Alors:
Hdeux + Cldeux => 2 HCl
C'est une réaction exothermique.
-Le HCl est produit en faisant réagir du chlorure de sodium avec de l'acide sulfurique. Processus qui peut être décrit de la manière suivante:
NaCl + HdeuxSW4 => NaHSO4 + HCl
Ensuite, le chlorure d'hydrogène est recueilli et le chlorure de sodium est mis à réagir avec le bisulfite de sodium selon la réaction suivante:
NaCl + NaHSO4 => NadeuxSW4 + HCl
Cette réaction a été introduite par Johan Glauber au 17ème siècle pour produire de l'acide chlorhydrique. Actuellement, il est principalement utilisé dans les laboratoires, car l'importance de son utilisation industrielle a diminué.
-L'acide chlorhydrique peut être produit comme sous-produit de la chloration de composés organiques, par exemple: dans la production de dichlorométhane.
CdeuxH4 + Cldeux => CdeuxH4Cldeux
CdeuxH4Cldeux => CdeuxH3Cl + HCl
Cette méthode de production de HCl est plus utilisée industriellement, en calculant que 90% du HCl produit aux États-Unis est par cette méthodologie.
-Et enfin, le HCl est produit lors de l'incinération des déchets organiques chlorés:
C4H6Cldeux + 5 Odeux => 4 COdeux + 2 heuresdeuxO + 2 HCl
Où est-il situé?
L'acide chlorhydrique est concentré dans la lumière gastrique où est atteint un pH de 1. L'existence d'une barrière muqueuse, riche en bicarbonate, empêche les cellules gastriques de subir des dommages dus à un pH gastrique bas..
Il existe trois principaux stimuli physiologiques pour la sécrétion de H+ par les cellules pariétales du corps gastrique: gastrine, histamine et acétylcholine.
Gastrine
La gastrine est une hormone sécrétée dans la région de l'antre gastrique qui agit en augmentant la concentration intracellulaire de Ca, un intermédiaire dans l'activation du transport H actif+ vers la lumière gastrique.
Le transport actif est effectué par une enzyme ATPase qui utilise l'énergie contenue dans l'ATP pour transporter H+ vers la lumière gastrique et introduisez K+.
Histamine
Il est sécrété par les soi-disant cellules de type entérochromaffine (SEC) du corps gastrique. Son action est médiée par une augmentation de la concentration d'AMP cyclique et agit en augmentant, comme la gastrine, le transport actif de H+ vers la lumière gastrique médiée par une pompe H+-K+.
Acétylcholine
Il est sécrété par les terminaisons nerveuses vagales, tout comme la gastrine médie son action par une augmentation du Ca intracellulaire, activant l'action de la pompe H.+-K+.
Le H+ des cellules pariétales provient de la réaction du COdeux avec le HdeuxO pour former HdeuxCO3 (acide carbonique). Cela se décompose plus tard en H+ et HCO3-. Le H+ il est activement transporté vers la lumière gastrique à travers la membrane apicale gastrique. Pendant ce temps, le HCO3- est introduit dans le sang couplé à l'entrée de Cl-.
Le mécanisme de contre-transport ou anti-transport Cl-HCO3- qui se produit dans la membrane basale des cellules pariétales produit l'accumulation intracellulaire de Cl-. Par la suite, l'ion passe dans la lumière gastrique accompagnant le H+. On estime que la sécrétion gastrique de HCl a une concentration de 0,15 M.
Autres sources de HCl biologique
Il existe d'autres stimuli pour la sécrétion de HCl par les cellules pariétales comme la caféine et l'alcool.
Les ulcères gastriques et duodénaux surviennent lorsque la barrière qui protège les cellules gastriques de l'action néfaste du HCl est perturbée..
En éliminant l'action protectrice susmentionnée, la bactérie Helicobacter pylori, l'acide acétylsalicylique et les anti-inflammatoires non stéroïdiens (AINS) contribuent à la production d'ulcères..
La sécrétion acide a pour fonction d'éliminer les microbes présents dans les aliments et d'initier la digestion des protéines, grâce à l'action de la pepsine. Les principales cellules du corps gastrique sécrètent du pepsinogène, une proenzyme qui est transformée en pepsine par le faible pH de la lumière gastrique.
Proprietes physiques et chimiques
Poids moléculaire
36,458 g / mol.
Couleur
C'est un liquide incolore ou légèrement jaunâtre.
Odeur
C'est une odeur âcre irritante.
Goût
Le seuil de dégustation est de l'eau pure soit une concentration de 1,3 x 10-4 moles / l.
Point d'ébullition
-121 ° F à 760 mmHg. -85,05 ° C à 760 mmHg.
Point de fusion
-174 ° F (-13,7 ° F) pour une solution de HCl à 39,7% p / p dans l'eau), -114,22 ° C.
Solubilité dans l'eau
La solution de HCl peut être de 67% p / p à 86 ° F; 82,3 g / 100 g d'eau à 0 ° C; 67,3 g / 100 g d'eau à 30 ° C et 63,3 g / 100 g d'eau à 40 ° C.
Solubilité dans le méthanol
51,3 g / 100 g de solution à 0 ° C et 47 g / 100 de solution à 20 ° C
Solubilité dans l'éthanol
41,0 / 100 g de solution à 20 ° C
Solubilité dans l'éther
24,9 g / 100 de solution à 20 ° C.
Densité
1,059 g / ml à 59 ° F dans une solution à 10,17% p / p.
Densité de gaz
1 00045 g / L
Densité de vapeur
1,268 (par rapport à l'air pris comme 1)
La pression de vapeur
32 452 mmHg à 70 ° F; 760 mmHg à -120,6 ° F
Stabilité
A une stabilité thermique élevée.
Auto-inflammation
Ce n'est pas inflammable.
Décomposition
Se décompose en chauffant en émettant une fumée de chlore toxique.
Viscosité: 0,405 cPoise (liquide à 118,6 º K), 0,0131 cPoise (vapeur à 273,06 º K).
Corrosivité
Il est très corrosif pour l'aluminium, le cuivre et l'acier inoxydable. Attaque tous les métaux (mercure, or, platine, argent, tantale à l'exception de certains alliages).
Tension superficielle
23 mN / cm à 118,6 ° K.
Polymérisation
Les aldéhydes et époxydes subissent une polymérisation violente en présence d'acide chlorhydrique.
Les propriétés physiques, telles que la viscosité, la pression de vapeur, le point d'ébullition et le point de fusion sont influencées par la concentration en pourcentage p / p de HCl.
Applications
L'acide chlorhydrique a de nombreuses utilisations à la maison, dans différentes industries, dans les laboratoires d'enseignement et de recherche, etc..
Industriel et domestique
-L'acide chlorhydrique est utilisé dans le traitement hydrométallurgique, par exemple dans la production d'alumine et de dioxyde de titane. Il est utilisé dans l'activation de la production de puits de pétrole.
L'injection de l'acide augmente la porosité autour de l'huile, favorisant ainsi son extraction..
-Il est utilisé pour l'élimination des dépôts de CaCO3 (carbonate de calcium) par sa transformation en CaCldeux (chlorure de calcium) qui est plus soluble et plus facile à éliminer. De même, il est utilisé industriellement dans le traitement de l'acier, un matériau aux multiples usages et applications, aussi bien dans l'industrie, dans la construction que dans la maison..
-Les maçons utilisent des solutions de HCl pour laver et nettoyer les briques. Il est utilisé à la maison pour nettoyer et désinfecter les salles de bain et leurs drains. De plus, l'acide chlorhydrique est utilisé dans les gravures, y compris les opérations de nettoyage des métaux..
-L'acide chlorhydrique a une application dans l'élimination de la couche d'oxyde de fer moisie qui s'accumule sur l'acier, avant son traitement ultérieur en extrusion, laminage, galvanisation, etc..
FoideuxOU ALORS3 + Fe + 6 HCl => 3 FeCldeux + HdeuxOU ALORS
-Bien qu'il soit très corrosif, il est utilisé pour éliminer les taches métalliques présentes dans le fer, le cuivre et le laiton, en utilisant une dilution de 1:10 dans l'eau..
Synthèse et réactions chimiques
-L'acide chlorhydrique est utilisé dans les réactions de titrage des bases ou des alcalis, ainsi que dans l'ajustement du pH des solutions. De plus, il est utilisé dans de nombreuses réactions chimiques, par exemple dans la digestion des protéines, procédure préalable aux études de la teneur en acides aminés et de leur identification..
-Une utilisation principale de l'acide chlorhydrique est la production de composés organiques, tels que le chlorure de vinyle et le dichlorométhane. L'acide est un intermédiaire dans la production de polycarbonates, de charbon actif et d'acide ascorbique.
-Il est utilisé dans la fabrication de colle. Alors que dans l'industrie textile, il est utilisé dans le blanchiment des tissus. Il est utilisé dans l'industrie du tannage du cuir, intervenant dans sa transformation. Il trouve également une utilisation comme engrais et dans la production de chlorure, de colorants, etc. Il est également utilisé dans la galvanoplastie, la photographie et l'industrie du caoutchouc..
-Il est utilisé dans la production de soie artificielle, dans le raffinage des huiles, graisses et savons. De plus, il est utilisé dans les réactions de polymérisation, d'isomérisation et d'alkylation..
Risques et toxicité
Il a une action corrosive sur la peau et les muqueuses, provoquant des brûlures. Ceux-ci, s'ils sont graves, peuvent provoquer des ulcérations, laissant des cicatrices chéloïdes et rétractiles. Le contact avec les yeux peut entraîner une réduction ou une perte totale de la vision en raison de lésions cornéennes..
Lorsque l'acide atteint le visage, il peut provoquer des cycles graves qui défigurent le visage. Un contact fréquent avec de l'acide peut également provoquer une dermatite..
L'ingestion d'acide chlorhydrique brûle la bouche, la gorge, l'œsophage et le tractus gastro-intestinal, provoquant des nausées, des vomissements et de la diarrhée. Dans les cas extrêmes, une perforation de l'œsophage et de l'intestin peut survenir, avec arrêt cardiaque et mort..
D'autre part, les vapeurs acides, en fonction de leur concentration, peuvent provoquer une irritation des voies respiratoires, provoquant une pharyngite, un œdème de la glotte, un rétrécissement des bronches avec bronchite, cyanose et œdème pulmonaire (accumulation excessive de liquide dans les poumons) et dans les cas extrêmes, la mort.
L'exposition à des niveaux élevés de vapeurs acides peut provoquer un gonflement de la gorge et des spasmes entraînant une suffocation..
Les nécroses dentaires qui apparaissent dans les dents avec la perte de leur brillance sont également fréquentes; deviennent jaunâtres et pâteux, finissant par se briser.
Prévention des dommages causés par l'acide chlorhydrique
Il existe un ensemble de règles pour la sécurité des personnes travaillant avec de l'acide chlorhydrique:
-Les personnes ayant des antécédents de maladies respiratoires et digestives ne devraient pas travailler dans des environnements contenant de l'acide..
-Les travailleurs doivent porter des vêtements résistants à l'acide, même avec des cagoules; lunettes de protection oculaire, protège-bras, gants résistants aux acides et chaussures ayant les mêmes caractéristiques. Ils doivent également porter des masques à gaz et en cas d'exposition sévère aux vapeurs d'acide chlorhydrique, l'utilisation d'un appareil respiratoire autonome est recommandée..
-L'environnement de travail doit également disposer de douches d'urgence et de fontaines pour se laver les yeux..
-De plus, il existe des normes pour les environnements de travail, telles que le type de sol, les circuits fermés, la protection des équipements électriques, etc..
Les références
- StudiousGuy. (2018). Acide chlorhydrique (HCl): utilisations et applications importantes. Tiré de: studiousguy.com
- Ganong, W. F. (2003). Revue de physiologie médicale. Vingt et unième édition. Les Compagnies McGraw-Hill INC.
- PubChem. (2018). Acide hydrochlorique. Tiré de: pubchem.ncbi.nlm.nih.gov
- Weebly. Acide hydrochlorique. Tiré de: psa-hydrochloric-acid.weebly.com
- CTR. Fiche de données de sécurité sur l'acide chlorhydrique. [PDF]. Tiré de: uacj.mx

Personne n'a encore commenté ce post.