
Propriétés des hydrocarbures aliphatiques, nomenclature, réactions, types
Les Hydrocarbures aliphatiques sont tous ceux qui manquent d'aromaticité, non pas au sens olfactif, mais en ce qui concerne la stabilité chimique. Cette classification des hydrocarbures est aujourd'hui trop ambiguë et imprécise, car elle ne fait pas de distinction entre les différents types d'hydrocarbures qui ne sont pas aromatiques..
Ainsi, nous avons des hydrocarbures aliphatiques et des hydrocarbures aromatiques. Ces derniers sont reconnus par leur unité de base: le cycle benzénique. Les autres, par contre, peuvent adopter n'importe quelle structure moléculaire: linéaire, ramifiée, cyclique, insaturée, polycyclique; tant qu'ils n'ont pas de systèmes conjugués comme le benzène.

Le terme «aliphatique» est né du mot grec «aleiphar», qui signifie graisse, également utilisé pour désigner les huiles. Par conséquent, au XIXe siècle, cette classification a été attribuée aux hydrocarbures obtenus à partir d'extraits huileux; tandis que les hydrocarbures aromatiques étaient extraits de résines d'arbres et de.
Cependant, au fur et à mesure que les fondements de la chimie organique se consolidaient, il a été découvert qu'il existait une propriété chimique qui différenciait les hydrocarbures, encore plus importante que leurs sources naturelles: l'aromaticité (et non le parfum)..
De cette manière, les hydrocarbures aliphatiques ont cessé d'être uniquement ceux obtenus à partir de matières grasses, pour être tous ceux qui manquaient d'aromaticité. Au sein de cette famille, nous avons des alcanes, des alcènes et des alcynes, qu'ils soient linéaires ou cycliques. C'est pourquoi «aliphatique» est considéré comme imprécis; bien qu'il soit utile d'aborder certains aspects généraux.
Par exemple, lorsque vous dites «extrémités» ou «chaînes» aliphatiques, vous faites référence à des régions moléculaires où les cycles aromatiques sont absents. De tous les hydrocarbures aliphatiques, le plus simple par définition est le méthane, CH4; tandis que le benzène est le plus simple des hydrocarbures aromatiques.
Index des articles
- 1 Propriétés des hydrocarbures aliphatiques
- 2 Nomenclature
- 3 réactions
- 3.1 Combustion
- 3.2 Ajout
- 3.3 Halogénation
- 3.4 Fissuration
- 4 types
- 5 utilisations
- 6 exemples
- 7 Références
Propriétés des hydrocarbures aliphatiques
Les propriétés des hydrocarbures aliphatiques varient à des degrés différents selon ceux qui sont considérés. Il y a ceux de masses moléculaires faibles et élevées, ainsi que linéaires, ramifiés, cycliques ou polycycliques, même ceux avec des structures tridimensionnelles étonnantes; comme avec le cubain, en forme de cube.
Cependant, il y a quelques généralités qui peuvent être mentionnées. La plupart des hydrocarbures aliphatiques sont des gaz ou des liquides hydrophobes et apolaires, certains étant plus apolaires que d'autres, puisque même ceux dont les chaînes carbonées contiennent des atomes d'halogène, d'oxygène, d'azote ou de soufre sont inclus..
De même, ce sont des composés inflammables, car ils sont sensibles à l'oxydation dans l'air avec une source de chaleur minimale. Cette caractéristique devient plus dangereuse si l'on ajoute sa forte volatilité, en raison des faibles interactions dispersives qui maintiennent les molécules aliphatiques ensemble..
On le voit par exemple dans le butane, un gaz qui se liquéfie relativement facilement comme le propane. Les deux sont très volatils et inflammables, ce qui en fait des composants actifs dans le gaz de cuisson ou les briquets de poche..
Bien entendu, cette volatilité a tendance à diminuer à mesure que la masse moléculaire augmente et l'hydrocarbure produit des liquides de plus en plus visqueux et huileux..
Nomenclature
La nomenclature des hydrocarbures diffère encore plus que leurs propriétés. S'il s'agit d'alcanes, d'alcènes ou d'alcynes, les mêmes règles stipulées par l'IUPAC sont suivies: sélectionner la chaîne la plus longue, attribuer les numéros d'indicateur les plus bas à l'extrémité la plus substituée ou aux hétéroatomes ou groupes les plus réactifs.
De cette manière, on sait sur quel carbone se trouve chaque substituant, voire les insaturations (doubles ou triples liaisons). Dans le cas des hydrocarbures cycliques, le nom est précédé des substituants classés par ordre alphabétique, suivis du mot «cycle», en comptant les nombres de carbone qui le composent..
Par exemple, considérons les deux cyclohexanes suivants:
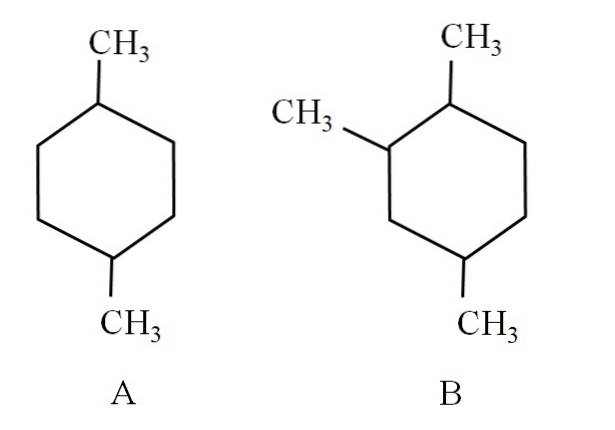
Le cyclohexane A est appelé 1,4-diméthylcyclohexane. Si le cycle était composé de cinq atomes de carbone, ce serait le 1,4-diméthylcyclopentane. Pendant ce temps, le cyclohexane B est appelé 1,2,4-triméthylcyclohexane, et non 1,4,6-cyclohexane, car il cherche à utiliser les indicateurs les plus bas..
Or, la nomenclature peut devenir très compliquée pour les hydrocarbures aux structures bizarres. Pour eux, il existe des règles plus spécifiques, qui doivent être expliquées séparément et soigneusement; comme avec les diènes, les terpènes, les polyènes et les composés polycycliques.
Réactions
La combustion
Heureusement, les réactions sont moins variées pour ces hydrocarbures. L'un d'eux a déjà été mentionné: ils brûlent facilement, produisant du dioxyde de carbone et de l'eau, ainsi que d'autres oxydes ou gaz en fonction de la présence d'hétéroatomes (Cl, N, P, O, etc.). Cependant, le COdeux et HdeuxOu sont-ils les principaux produits de la combustion.
Une addition
S'ils présentent des insaturations, ils peuvent subir des réactions d'addition; c'est-à-dire qu'ils incorporent de petites molécules dans leur squelette en tant que substituants suivant un mécanisme spécifique. Parmi ces molécules, nous avons l'eau, l'hydrogène et les halogènes (Fdeux, Cldeux, Brdeux et moideux).
Halogénation
D'autre part, les hydrocarbures aliphatiques sous l'incidence du rayonnement ultraviolet (hv) et la chaleur peut rompre les liaisons C-H pour les échanger contre des liaisons C-X (C-F, C-Cl, etc.). Il s'agit de la réaction d'halogénation, qui s'observe dans les alcanes à très courte chaîne, comme le méthane ou le pentane..
Craquer
Une autre réaction que peuvent subir les hydrocarbures aliphatiques, en particulier les alcanes à longue chaîne, est le craquage thermique. Il consiste en l'apport de chaleur intense afin que l'énergie thermique casse les liaisons C-C, et ainsi de petites molécules se forment, plus valorisées sur le marché des carburants, à partir de grosses molécules.
Les quatre réactions ci-dessus sont les principales qu'un hydrocarbure aliphatique peut subir, la combustion étant la plus importante de toutes, car elle ne discrimine aucun composé; tous brûlent en présence d'oxygène, mais tous ne vont pas ajouter des molécules ou se décomposer en petites molécules.
Les types
Les hydrocarbures aliphatiques regroupent un nombre infini de composés, qui à leur tour sont classés de manière plus spécifique, indiquant le degré de leurs insaturations, ainsi que le type de structure qu'ils ont..
Selon leur insaturation, nous avons des alcanes (saturés), des alcènes et des alcynes (insaturés).
Les alcanes sont caractérisés par des liaisons simples C-C, tandis que dans les alcènes et les alcynes, nous observons respectivement des liaisons C = C et C≡C. Une manière très générale de les visualiser est de penser aux squelettes carbonés des alcanes comme des chaînes en zigzag et pliées, étant des «carrés» pour les alcènes et des «lignes droites» pour les alcynes..
Cela est dû au fait que les doubles et triples liaisons présentent une énergie et une restriction stérique dans leurs rotations, "durcissant" leurs structures..
Les alcanes, alcènes et alcynes peuvent être ramifiés, cycliques ou polycycliques. C'est pourquoi les cycloalcanes, cycloalcènes, cycloalcines et composés tels que la décaline (structure bicyclo), l'adamantane (similaire à une casquette de baseball), l'heptalène, le gonane, entre autres, sont également considérés comme des hydrocarbures aliphatiques..
D'autres types d'hydrocarbures proviennent d'alcènes, tels que les diènes (avec deux doubles liaisons), les polyènes (avec de nombreuses doubles liaisons alternées) et les terpènes (composés dérivés de l'isoprène, un diène).
Applications
Là encore, les utilisations de ces hydrocarbures peuvent varier en fonction de celui qui est considéré. Cependant, dans les sections sur les propriétés et les réactions, il a été précisé qu'ils brûlent tous, non seulement pour libérer des molécules gazeuses, mais aussi de la lumière et de la chaleur. Ainsi, ce sont des réservoirs d'énergie, utiles pour servir de combustibles ou de sources de chaleur..
C'est pourquoi ils sont utilisés dans le cadre de la composition de l'essence, pour le gaz naturel, dans les brûleurs Bunsen, et en général pour pouvoir allumer des incendies..
L'un des exemples les plus notables est celui de l'acétylène, HC≡CH, dont la combustion permet d'exciter les ions métalliques d'un échantillon en spectrométrie d'absorption atomique réalisée dans des tests analytiques. En outre, le feu résultant peut être utilisé pour le soudage.
Les hydrocarbures aliphatiques liquides, tels que les paraffiniques, sont fréquemment utilisés comme solvants d'extraction des graisses. De plus, son action solvant peut être utilisée pour éliminer les taches, les émaux, les peintures, ou simplement pour préparer des solutions d'un certain composé organique.
Ceux ayant la masse moléculaire la plus élevée, qu'ils soient visqueux ou solides, sont utilisés pour la production de résines, de polymères ou de médicaments.
Quant au terme «aliphatique», il est souvent utilisé pour désigner les régions, dans une macromolécule, qui manquent d'aromaticité. Par exemple, les asphaltènes sont décrits superficiellement comme un noyau aromatique avec des chaînes aliphatiques.
Exemples
Au début, on a dit que le méthane était le plus simple des hydrocarbures aliphatiques. Il est suivi du propane, CH3CHdeuxCH3, butane, CH3CHdeuxCHdeuxCH3, pentane, CH3CHdeuxCHdeuxCHdeuxCH3, octane, nonane, doyen, etc., ayant des alcanes de plus en plus longs.
Il en va de même pour l'éthylène, CHdeux= CHdeux, propène, CH3CH = CHdeux, butène, CH3CHdeuxCH = CH3, et pour le reste des alcynes. S'il y a deux doubles liaisons, ce sont des diènes, et s'il y en a plus de deux, des polyènes. De même, il peut y avoir des doubles et des triples liaisons dans le même squelette, ce qui augmente la complexité structurelle..
Parmi les cycloalcanes, on peut citer le cyclopropane, le cyclobutane, le cyclopentane, le cyclohexane, le cycloheptane, le cyclooctane, ainsi que le cyclohexène et la cyclohexine. Des dérivés ramifiés sont quant à eux obtenus à partir de tous ces hydrocarbures, les exemples disponibles se multipliant encore plus (comme le 1,4-diméthylcyclohexane).
Parmi les terpènes les plus représentatifs, nous avons le limonène, le menthol, le pinène, la vitamine A, le squalène, etc. Le polyéthylène est un polymère saturé d'unités -CHdeux-CHdeux-, c'est donc aussi un exemple de ces hydrocarbures. D'autres exemples ont déjà été cités dans les sections précédentes.
Les références
- Morrison, R. T. et Boyd, R, N. (1987). Chimie organique. 5e édition. Éditorial Addison-Wesley Interamericana.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (10e édition.). Wiley plus.
- Helmenstine, Anne Marie, Ph.D. (22 août 2019). Définition des hydrocarbures aliphatiques. Récupéré de: thinkco.com
- Wikipédia. (2019). Composé aliphatique. Récupéré de: en.wikipedia.org
- Chimie LibreTexts. (20 août 2019). Hydrocarbures aliphatiques. Récupéré de: chem.libretexts.org
- Elizabeth Wyman. (2019). Hydrocarbures aliphatiques: définition et propriétés. Étude. Récupéré de: study.com



Personne n'a encore commenté ce post.