
Structure de l'hydroxyde d'aluminium, propriétés, utilisations, risques
le hydroxyde d'aluminium est un composé inorganique dont la formule chimique est Al (OH)3. Contrairement aux autres hydroxydes métalliques, il s'agit d'un amphotère, capable de réagir ou de se comporter comme un acide ou une base, selon le milieu. C'est un solide blanc assez insoluble dans l'eau, il est donc utilisé comme composant d'antiacides.
Comme Mg (OH)deux ou la brucite, avec laquelle elle partage certaines caractéristiques chimiques et physiques, sous forme pure, elle ressemble à un solide terne et amorphe; mais quand il cristallise avec quelques impuretés, il acquiert des formes cristallines comme s'il s'agissait de perles. Parmi ces minéraux, sources naturelles d'Al (OH)3, le gibbsite est trouvé.

En plus de la gibbsite, il y a aussi les minéraux bayerite, nordstrandite et doleyite, qui constituent les quatre polymorphes de l'hydroxyde d'aluminium. Structurellement, ils sont très similaires les uns aux autres, ne différant guère dans la manière dont les couches ou feuilles d'ions sont positionnées ou couplées, ainsi que le type d'impuretés contenues.
En contrôlant le pH et les paramètres de synthèse, n'importe lequel de ces polymorphes peut être préparé. En outre, certaines espèces chimiques d'intérêt peuvent être intercalées entre ses couches, de sorte que des matériaux ou des composés d'intercalation sont créés. Cela représente l'utilisation d'une approche plus technologique pour Al (OH)3. Ses autres utilisations sont comme antiacides.
D'autre part, il est utilisé comme matière première pour obtenir de l'alumine, et ses nanoparticules ont été utilisées comme support catalytique..
Index des articles
- 1 Structure
- 1.1 Formule et octaèdre
- 1.2 Polymorphes
- 2 propriétés
- 2.1 Apparence physique
- 2.2 Masse molaire
- 2.3 Densité
- 2.4 Point de fusion
- 2.5 Solubilité dans l'eau
- 2.6 Produit de solubilité
- 2.7 Amphotéricisme
- 3 Nomenclature
- 4 utilisations
- 4.1 Matière première
- 4.2 Supports catalytiques
- 4.3 Composés d'intercalation
- 4.4 Ignifuge
- 4.5 Médicinal
- 4.6 Adsorbant
- 5 risques
- 6 Références
Structure
Formule et octaèdre
La formule chimique Al (OH)3 indique aussitôt que la relation Al3+: OH- vaut 1: 3; c'est-à-dire qu'il y a trois anions OH- pour chaque cation Al3+, ce qui revient à dire qu'un tiers de ses ions correspondent à l'aluminium. Ainsi, l'Al3+ et OH- interagissent électrostatiquement jusqu'à ce que leurs répulsions d'attraction définissent un cristal hexagonal.
Cependant, l'Al3+ pas nécessairement entouré de trois OH- mais six; on parle donc d'un octaèdre de coordination, Al (OH)6, dans lequel il y a six interactions Al-O. Chaque octaèdre représente une unité avec laquelle le cristal est construit, et un certain nombre d'entre eux adoptent des structures tricliniques ou monocliniques.
L'image du bas représente partiellement les octaèdres Al (OH)6, puisque seulement quatre interactions sont observées pour l'Al3+ (sphères marron clair).
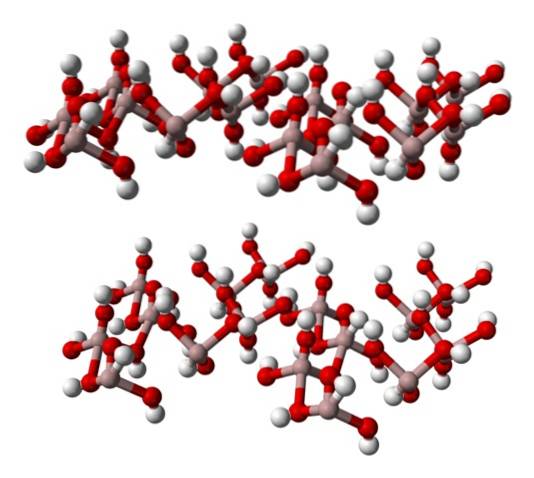
Si l'on observe attentivement cette structure, qui correspond à celle de la gibbsite minérale, on constate que les sphères blanches constituent les «faces» ou surfaces des couches ioniques; ce sont les atomes d'hydrogène des ions OH-.
A noter également qu'il y a une couche A et une autre B (spatialement elles ne sont pas identiques), reliées entre elles par des liaisons hydrogène..
Polymorphes
Les couches A et B ne sont pas toujours couplées de la même manière, tout comme leurs environnements physiques ou leurs ions hôtes (sels) peuvent changer. Par conséquent, les cristaux d'Al (OH)3 varient en quatre formes minéralogiques ou, dans ce cas, polymorphes.
On dit alors que l'hydroxyde d'aluminium a jusqu'à quatre polymorphes: gibbsite ou hydrargillite (monoclinique), bayerite (monoclinique), doyleite (triclinique) et nordstrandite (triclinique). De ces polymorphes, la gibbsite est la plus stable et la plus abondante; les autres sont classés comme minéraux rares.
Si les cristaux étaient observés au microscope, on verrait que leur géométrie est hexagonale (bien qu'un peu irrégulière). Le pH joue un rôle important dans la croissance de tels cristaux et sur la structure résultante; c'est-à-dire, étant donné un pH, un polymorphe ou un autre peut se former.
Par exemple, si le milieu où Al (OH) précipite3 il a un pH inférieur à 5,8 gibbsite se forme; tandis que si le pH est supérieur à cette valeur, de la bayerite se forme.
Dans les milieux plus basiques, des cristaux de nordstrandite et de doyleite ont tendance à se former. Ainsi, étant le gibbsite le plus abondant, c'est un fait qui reflète l'acidité de ses milieux altérés..
Propriétés
Apparence physique
Solide blanc pouvant se présenter sous différents formats: granuleux ou en poudre, et d'apparence amorphe.
Masse molaire
78,00 g / mol
Densité
2,42 g / mL
Point de fusion
300 ° C Il n'a pas de point d'ébullition car l'hydroxyde perd de l'eau pour se transformer en alumine ou en oxyde d'aluminium, AldeuxOU ALORS3.
Solubilité dans l'eau
1 10-4 g / 100 ml. Cependant, sa solubilité augmente avec l'ajout d'acides (H3OU ALORS+) ou des alcalis (OH-).
Produit de solubilité
Ksp = 3 10−34
Cette très petite valeur signifie que seule une infime partie se dissout dans l'eau:
Al (OH)3(s) <=> Au3+(aq) + 3OH-(ac)
Et en fait cette solubilité négligeable en fait un bon neutralisant d'acidité, car il ne basifie pas trop l'environnement gastrique car il ne libère presque pas d'ions OH.-.
Amphotéricisme
El Al (OH)3 il se caractérise par son caractère amphotère; c'est-à-dire qu'il peut réagir ou se comporter comme s'il s'agissait d'un acide ou d'une base.
Par exemple, il réagit avec les ions H3OU ALORS+ (si le milieu est aqueux) pour former le complexe aqueux [Al (OHdeux)6]3+; qui à son tour est hydrolysé pour acidifier le milieu, donc Al3+ un ion acide:
Al (OH)3(s) + 3H3OU ALORS+(ac) => [Al (OHdeux)6]3+(ac)
[Al (OHdeux)6]3+(ac) + HdeuxO (l) <=> [Al (OHdeux)5(OH)]deux+(ac) + H3OU ALORS+(ac)
Lorsque cela se produit, on dit que l'Al (OH)3 se comporte comme une base, car il réagit avec le H3OU ALORS+. En revanche, il peut réagir avec l'OH-, se comportant comme un acide:
Al (OH)3(s) + OH-(ac) => Al (OH)4-(ac)
Dans cette réaction, le précipité blanc d'Al (OH)3 se dissout en excès d'ions OH-; fait que ne se passe pas la même chose avec d'autres hydroxydes, tels que le magnésium, le Mg (OH)deux.
El Al (OH)4-, ion aluminate, peut être exprimé de manière plus appropriée par: [Al (OHdeux)deux(OH)4]-, mettant en évidence le numéro de coordination de 6 pour le cation Al3+ (l'octaèdre).
Cet ion peut continuer à réagir avec plus d'OH- jusqu'à la fin de l'octaèdre de coordination: [Al (OH)6]3-, appelé ion hexahydroxoaluminate.
Nomenclature
La dénomination «hydroxyde d'aluminium», avec laquelle il a été fait davantage référence à ce composé, correspond à celle régie par la nomenclature de base. Le (III) est omis à la fin de celui-ci, car l'état d'oxydation de l'aluminium est de +3 dans tous ses composés.
Les deux autres noms possibles pour désigner Al (OH)3 Ce sont: le trihydroxyde d'aluminium, selon la nomenclature systématique et l'utilisation des préfixes numérateurs grecs; et hydroxyde d'aluminium, se terminant par le suffixe -ico pour avoir un seul état d'oxydation.
Bien que dans le domaine chimique la nomenclature de Al (OH)3 ne représente aucun défi ou confusion, en dehors de cela, il a tendance à être mélangé à des ambiguïtés.
Par exemple, la gibbsite minérale est l'un des polymorphes naturels d'Al (OH)3, qu'ils appellent également γ-Al (OH)3 ou α-Al (OH)3. Cependant, α-Al (OH)3 peut également correspondre à la bayerite minérale, ou β-Al (OH)3, selon la nomenclature cristallographique. Pendant ce temps, les polymorphes nordstrandite et doyleite sont généralement désignés simplement comme Al (OH)3.
La liste suivante résume clairement ce qui vient d'être expliqué:
-Gibbsite: (γ ou α) -Al (OH)3
-Bayérite: (α ou β) -Al (OH)3
-Nordstrandite: Al (OH)3
-Doyleite: Al (OH)3
Applications
Matière première
L'utilisation immédiate de l'hydroxyde d'aluminium est comme matière première pour la production d'alumine ou d'autres composés, inorganiques ou organiques, d'aluminium; par exemple: AlCl3, En ne3)3, AlF3 ou NaAl (OH)4.
Supports catalytiques
Nanoparticules d'Al (OH)3 ils peuvent servir de supports catalytiques; c'est-à-dire que le catalyseur les rejoint pour rester fixé sur leur surface, où les réactions chimiques sont accélérées.
Composés d'intercalation
Dans la section sur les structures, il a été expliqué que Al (OH)3 Il se compose de couches ou feuilles A et B, couplées pour définir un cristal. À l'intérieur, il y a de petits espaces ou trous octaédriques qui peuvent être occupés par d'autres ions, métalliques ou organiques, ou des molécules neutres..
Lorsque les cristaux d'Al (OH) sont synthétisés3 Avec ces modifications structurelles, on dit qu'un composé d'intercalation est en cours de préparation; c'est-à-dire qu'ils insèrent ou insèrent des espèces chimiques entre les feuilles A et B. Ce faisant, de nouveaux matériaux fabriqués à partir de cet hydroxyde émergent.
Retardateur de flamme
El Al (OH)3 c'est un bon ignifuge qui trouve une application comme matériau de remplissage pour de nombreuses matrices polymères. C'est parce qu'il absorbe la chaleur pour libérer de la vapeur d'eau, tout comme le fait le Mg (OH).deux ou la brucita.
Médicinal
El Al (OH)3 C'est aussi un neutralisant de l'acidité, réagissant avec le HCl dans les sécrétions gastriques; encore une fois, de manière similaire à Mg (OH)deux lait de magnésie.
Les deux hydroxydes peuvent en effet être mélangés à différents antiacides, utilisés pour soulager les symptômes des personnes souffrant de gastrite ou d'ulcères d'estomac..
Adsorbant
Lorsqu'il est chauffé en dessous de son point de fusion, l'hydroxyde d'aluminium se transforme en alumine activée (ainsi qu'en charbon actif). Ce solide est utilisé comme adsorbant pour des molécules indésirables, qu'il s'agisse de colorants, d'impuretés ou de gaz polluants..
Des risques
Les risques que peut présenter l'hydroxyde d'aluminium ne lui sont pas dus en tant que solide, mais en tant que médicament. Il n'a besoin d'aucun protocole ou règlement pour le stocker, car il ne réagit pas vigoureusement avec les agents oxydants et il n'est pas inflammable..
Lorsqu'ils sont ingérés dans des antiacides disponibles en pharmacie, des effets indésirables peuvent survenir, tels que la constipation et l'inhibition du phosphate dans les intestins. De même, et bien qu'aucune étude ne le prouve, il a été associé à des troubles neurologiques tels que la maladie d'Alzheimer.
Les références
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2019). Hydroxyde d'aluminium. Récupéré de: en.wikipedia.org
- Centre national d'information sur la biotechnologie. (2019). Hydroxyde d'aluminium. Base de données PubChem. CID = 10176082. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Danielle Reid. (2019). Hydroxyde d'aluminium: formule et effets secondaires. Étude. Récupéré de: study.com
- Robert Schoen et Charles E. Roberson. (1970). Structures d'hydroxyde d'aluminium et implications géochimiques. Le minéralogiste américain, Vol 55.
- Vitaly P. Isupov et col. (2000). Synthèse, structure, propriétés et application des composés d'intercalation d'hydroxyde d'aluminium. Chimie au service du développement durable 8121-127.
- Drogues. (24 mars 2019). Effets secondaires d'hydroxyde d'aluminium. Récupéré de: drug.com



Personne n'a encore commenté ce post.