
Structure de l'hydroxyde de magnésium, propriétés, nomenclature, utilisations
le l'hydroxyde de magnésium est un composé inorganique dont la formule chimique est Mg (OH)deux. Dans sa forme pure, il s'agit d'un solide blanc terne d'aspect amorphe; Cependant, avec une teneur faible et exacte en impuretés, il se transforme en brucite solide cristalline, un minéral trouvé dans certains gisements dans la nature, et est une riche source de magnésium..
C'est un électrolyte ou une base faible, donc sa dissociation est faible en eau. Cette propriété rend Mg (OH)deux un bon neutralisant d'acidité pour la consommation humaine; remède populairement connu sous le nom de suspension de lait de magnésie. C'est aussi un ignifuge en libérant de l'eau lors de sa décomposition thermique..

Dans l'image supérieure, certains solides d'hydroxyde de magnésium sont représentés, dans lesquels sa couleur blanche opaque peut être appréciée. Plus ils sont cristallins, ils développent des surfaces vitreuses et nacrées.
Sa structure cristalline est particulière car elle établit des cristaux hexagonaux à double couche, qui sont des conceptions prometteuses pour la conception de nouveaux matériaux. Dans ces couches, leurs charges positives jouent un rôle important en raison de la substitution de Mgdeux+ par les cations trivalents, et les espèces confinées entre les parois composées d'anions OH-.
D'autre part, d'autres applications dérivent en fonction de la morphologie des particules ou nanoparticules préparées; comme catalyseurs ou adsorbants. Dans tous, le rapport 1: 2 pour les ions Mg est maintenu constant.deux+: OH-, reflété dans la même formule Mg (OH)deux.
Index des articles
- 1 Structure
- 1.1 Formule et octaèdre
- 1.2 Double couche
- 1.3 Morphologies
- 2 propriétés
- 2.1 Apparence physique
- 2.2 Masse molaire
- 2.3 Densité
- 2.4 Point de fusion
- 2.5 Solubilité dans l'eau
- 2.6 Indice de réfraction
- 2,7 pH
- 2.8 Capacité thermique
- 3 Où est-il situé?
- 4 Nomenclature
- 5 utilisations
- 5.1 Neutralisant
- 5.2 Antiacide
- 5.3 Ignifuge
- 5.4 Catalyseur
- 5.5 Adsorbant
- 6 Références
Structure
Formule et octaèdre
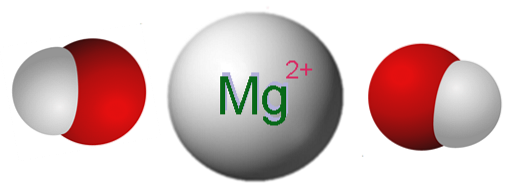
L'image ci-dessus montre les ions qui composent le Mg (OH)deux. Comme on peut le voir, il y a deux anions OH- pour chaque cation Mgdeux+, qui interagissent électrostatiquement pour définir un cristal avec une structure hexagonale. La même formule indique que le rapport Mg: OH est de 1: 2.
Cependant, la véritable structure cristalline est un peu plus complexe que de supposer de simples ions Mg.deux+ et OH-. En fait, le magnésium se caractérise par un nombre de coordination de 6, de sorte qu'il peut interagir avec jusqu'à six OH-.
Ainsi, l'octaèdre Mg (OH) est formé6, où les atomes d'oxygène proviennent évidemment de l'OH-; et la structure cristalline repose maintenant sur la prise en compte de ces octaèdres et de leur interaction.
En fait, les unités Mg (OH)6 finissent par définir des structures à double couche qui, à leur tour, sont disposées dans l'espace pour donner naissance au cristal hexagonal.
Couche double
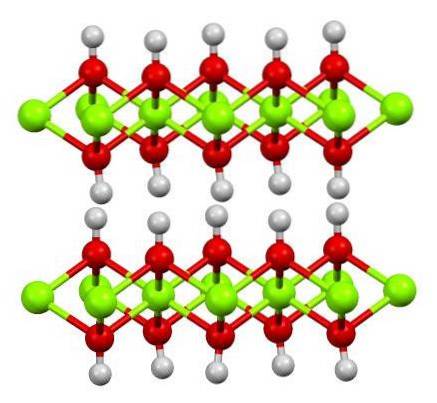
L'image du haut montre la structure à double couche d'hydroxyde de magnésium (LDH): Hydroxydes doubles en couches). Les sphères vertes représentent les ions Mgdeux+, qui pourraient être remplacés par d'autres avec une charge plus élevée pour générer une charge positive dans la couche.
Notez qu'autour de chaque Mgdeux+ il y a six sphères rouges reliées à leurs sphères blanches respectives; c'est-à-dire les unités octaédriques Mg (OH)6. L'OH- agit comme un pont pour joindre deux Mgdeux+ de plans différents, ce qui rend les couches entrelacées.
De même, on observe que les atomes d'hydrogène pointent vers le haut et vers le bas et sont principalement responsables des forces intermoléculaires qui maintiennent ensemble les deux couches d'unités Mg (OH).6.
Des molécules neutres (comme les alcools, l'ammoniac et l'azote) ou même des anions peuvent se loger entre ces couches, selon leur degré de positif (s'il y a des ions Al3+ o foi3+ remplacement de Mgdeux+). La «charge» de ces espèces est confinée par les surfaces composées des anions OH-.
Les morphologies
Le verre hexagonal à double couche se développe lentement ou rapidement. Tout dépend des paramètres de synthèse ou de préparation: température, rapport molaire, agitation, solvants, réactifs comme source de magnésium, bases ou agents précipitants, etc. Au fur et à mesure que le cristal grandit, il définit la microstructure ou la morphologie de ses nanoparticules ou agrégats.
Ainsi, ces nanoparticules peuvent avoir des morphologies en forme de plaque, de plaquette ou de globule en forme de chou-fleur. De même, la distribution de leurs tailles peut changer, tout comme le degré de porosité des solides résultants..
Propriétés
Apparence physique
C'est un solide blanc, granuleux ou en poudre, et sans odeur.
Masse molaire
58,3197 g / mol.
Densité
3,47 g / mL.
Point de fusion
350 ° C A cette température, il se décompose en oxyde en libérant les molécules d'eau contenues dans ses cristaux:
Mg (OH)deux(s) => MgO (s) + HdeuxO (g)
Solubilité dans l'eau
0,004 g / 100 ml à 100 ° C; c'est-à-dire qu'il se dissout à peine dans l'eau bouillante, ce qui en fait un composé insoluble dans l'eau. Cependant, à mesure que le pH diminue (ou que l'acidité augmente), sa solubilité augmente en raison de la formation du complexe aqueux, Mg (OHdeux)6.
En revanche, si le Mg (OH)deux a absorbé du COdeux, libère du gaz retenu sous forme d'effervescence lorsqu'il est dissous dans un milieu acide.
Indice de réfraction
1 559
pH
Une suspension aqueuse de celui-ci a un pH qui varie entre 9,5 et 10,5. Bien que ces valeurs soient normales, elles reflètent sa faible basicité par rapport aux autres hydroxydes métalliques (tels que NaOH).
Capacité thermique
77,03 J / mol K
Où est-il situé?

L'hydroxyde de magnésium peut être trouvé dans la nature sous forme de brucite minérale, qui se caractérise par sa couleur blanche transparente, avec des tons verts ou bleuâtres selon ses impuretés. De même, la brucite fait partie de certaines argiles, comme le chlorite, car elle est prise en sandwich entre les couches de silicates, jointes par des ions métalliques..
Dans la brucite, il y a d'autres ions en plus du Mgdeux+, comme Al3+, Foi3+, Zndeux+ et Mndeux+. Ses minerais se trouvent dans différentes régions ou lacs d'Écosse, du Canada, d'Italie et des États-Unis..
Physiquement, ses cristaux ressemblent à du verre fondu (image du haut), avec des couleurs blanches, grisâtres, bleuâtres ou verdâtres, et transparents dans de rares spécimens.
Ce minéral est l'un des maux qui affectent les ciments et le béton, car il a tendance à se dilater et à provoquer des fractures. Cependant, il n'absorbe pas le COdeux, donc sa calcination ne contribue pas à l'effet de serre et, par conséquent, c'est une source minéralogique appropriée (et la plus riche) pour obtenir du magnésium, en plus de l'eau de mer.
Nomenclature
Mg (OH)deux Il a jusqu'à trois noms acceptés par l'IUPAC (en dehors de la minéralogie ou de la médecine). Ceux-ci sont très similaires les uns aux autres, car la façon dont ils finissent varie à peine..
Par exemple, `` hydroxyde de magnésium '' correspond à son nom selon la nomenclature du stock, en omettant (II) à la fin car +2 est presque par défaut le seul état d'oxydation du magnésium.
`` Dihydroxyde de magnésium '', désignant le nombre d'ions OH avec le préfixe numérateur grec- indiqué dans la formule selon la nomenclature systématique. Et «hydroxyde de magnésium», se terminant par le suffixe -ico pour être l'état d'oxydation maximal et «unique» du magnésium, selon la nomenclature traditionnelle..
Les autres noms, comme la brucite ou la magnésie du lait, bien qu'ils soient directement liés à ce composé, il est déconseillé de s'y référer lorsqu'il s'agit de son solide le plus pur, ou en tant que composé inorganique (réactif, matière première, etc.).
Applications
Neutralisant
Mg (OH)deux Il doit à sa faible solubilité dans l'eau le fait qu'il est un excellent neutralisant d'acidité; sinon, il basifierait le milieu en fournissant de grandes concentrations d'ions OH-, tout comme les autres bases (électrolytes puissants).
Ainsi, Mg (OH)deux libère à peine OH-, en réagissant avec les ions H3OU ALORS+ pour former le complexe aqueux de magnésium, également mentionné ci-dessus. Pouvant neutraliser l'acidité des milieux aqueux, il est destiné au traitement des eaux usées.
C'est également un additif aux aliments, aux engrais et à certains produits d'hygiène personnelle, comme le dentifrice, car il réduit leur acidité..
Antiacide
Étant légèrement soluble dans l'eau, il peut être ingéré sans risquer les effets de ses ions OH- (se dissocie très peu en tant qu'électrolyte faible).
Cette caractéristique, liée à la sous-section ci-dessus, en fait un antiacide pour traiter les brûlures d'estomac, les maladies gastro-intestinales, l'indigestion et la constipation, vendu sous la formule de lait de magnésie.
D'autre part, le lait de magnésie aide également à combattre les aphtes gênants (les plaies blanches et rouges qui apparaissent dans la bouche).
Retardateur de flamme
Dans la section des propriétés, il a été mentionné que Mg (OH)deux se décompose en libérant de l'eau. Précisément, cette eau aide à arrêter l'avancée des flammes, puisqu'elles absorbent la chaleur pour se vaporiser et, à leur tour, les vapeurs diluent les gaz combustibles ou inflammables..
Le minéral de brucite est généralement utilisé industriellement à cet effet, destiné comme charge dans certains matériaux, tels que les plastiques de différents polymères (PVC, résines, caoutchoucs), les câbles ou les plafonds..
Catalyseur
Mg (OH)deux synthétisé sous forme de nanoplaques, il s'est avéré efficace pour catalyser les réductions chimiques; par exemple, celui du 4-nitrophénol (Ph-NOdeux) au 4-aminophénol (Ph-NHdeux). Ils ont également une activité antibactérienne, de sorte qu'il pourrait être utilisé comme agent thérapeutique..
Adsorbant
Certains solides de Mg (OH)deux ils peuvent être assez poreux, selon la méthode de leur préparation. Par conséquent, ils trouvent une application comme adsorbants.
Dans les solutions aqueuses, ils peuvent adsorber (sur leurs surfaces) les molécules de colorant, clarifiant l'eau. Par exemple, ils sont capables d'adsorber le colorant indigo carmin présent dans les courants d'eau..
Les références
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2019). L'hydroxyde de magnésium. Récupéré de: en.wikipedia.org
- Centre national d'information sur la biotechnologie. (2019). L'hydroxyde de magnésium. Base de données PubChem. CID = 14791. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Galeries d'améthyste. (2014). La brucite minérale. Récupéré de: galleries.com
- Henrist et coll. (2003). Etude morphologique des nanoparticules d'hydroxyde de magnésium
- précipité dans une solution aqueuse diluée. Journal of Crystal Growth 249, 321-330.
- Saba J., Shanza R. K., Muhammad R. S. (2018). Synthèse et analyse structurale de nanoparticules d'hydroxyde de magnésium mésoporeux comme catalyseur efficace.
- Thimmasandra Narayan Ramesh et Vani Pavagada Sreenivasa. (2015). Élimination du colorant indigo carmin d'une solution aqueuse à l'aide d'hydroxyde de magnésium comme adsorbant. Journal of Materials, vol. 2015, numéro d'article 753057, 10 pages. doi.org/10.1155/2015/753057


Personne n'a encore commenté ce post.