
Structure de l'hydroxyde de sodium (NaOH), propriétés, utilisations, synthèse

le hydroxyde de sodium C'est un composé inorganique dont la formule chimique est NaOH et se compose d'une base métallique ou alcaline très forte. Une solution à 5% de celui-ci dans l'eau a un pH proche de 14.
C'est un solide blanc très hygroscopique qui peut également absorber le dioxyde de carbone de l'air pour former du carbonate de sodium. Il est commercialisé dans des bouteilles en plastique sous forme de pilules, qui ne peuvent pas être exposées trop longtemps à l'air, ni ne doivent être manipulées avec des spatules..

L'hydroxyde de sodium peut être synthétisé en faisant réagir l'hydroxyde de calcium avec du carbonate de sodium. Actuellement, cependant, il est fondamentalement synthétisé par électrolyse de la saumure et est un sous-produit de la production de chlore gazeux..
Compte tenu de la forte basicité du NaOH, il a de nombreuses utilisations et applications, telles que la production de papier, de savons, de détergents, de colorants, etc. Il est également utilisé dans le nettoyage domestique, le traitement de l'eau, le traitement de l'aluminium, la fabrication de médicaments, etc. et surtout, c'est un modèle secondaire par excellence.
L'hydroxyde de sodium est très corrosif, pouvant provoquer des irritations et des brûlures de la peau et des yeux. En inhalant sa poussière, il peut provoquer un œdème pulmonaire. Pendant ce temps, son ingestion peut causer des dommages si graves au tube digestif qu'elle peut entraîner la mort..
Index des articles
- 1 Structure
- 1.1 anhydre
- 1.2 Hydrate
- 2 Propriétés physiques et chimiques
- 2.1 Noms
- 2.2 Masse molaire
- 2.3 Apparence
- 2.4 Point de fusion
- 2.5 Point d'ébullition
- 2.6 Solubilité dans l'eau
- 2.7 Basicité (pKb)
- 2,8 pH
- 2.9 Indice de réfraction (nD)
- 2.10 Stabilité
- 2.11 Décomposition
- 2.12 Point d'auto-inflammation
- 2.13 Viscosité
- 2.14 Chaleur de vaporisation
- 2.15 Tension superficielle
- 2.16 Réactivité
- 3 Synthèse
- 3.1 Réaction du carbonate de sodium et de l'hydroxyde de calcium
- 3.2 Electrolyse du chlorure de sodium
- 4 utilisations
- 4.1 Produits de nettoyage
- 4.2 Produits pharmaceutiques et médicaments
- 4.3 Processus énergétiques
- 4.4 Traitement de l'eau
- 4.5 Fabrication du papier
- 4.6 Fabrication industrielle
- 5 risques
- 6 Références
Structure
Anhydre

L'image du haut montre les ions qui composent NaOH. Le cation Na+ est représenté par la sphère violette, tandis que l'anion hydroxyle (hydroxyde ou hydroxyle) OH- par la sphère rouge et blanche. Les deux ions Na+ et OH- interagissent les uns avec les autres par l'attraction électrostatique de leurs charges opposées.
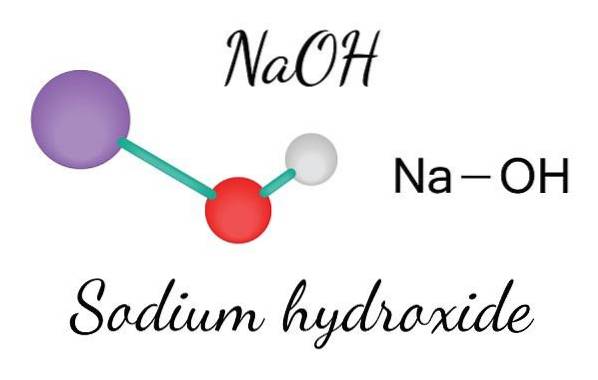
De telles interactions sont non directionnelles, donc les attractions d'une paire d'ions Na+Oh- il peut affecter ceux des autres à une certaine distance. Le résultat est que les ions Na+ se repousser, de la même manière que OH-, jusqu'à définir un cristal d'énergie minimale où ils établissent une structure ordonnée et périodique (cristalline).
Par conséquent, les cristaux orthorhombiques de NaOH anhydre (sans eau) apparaissent:
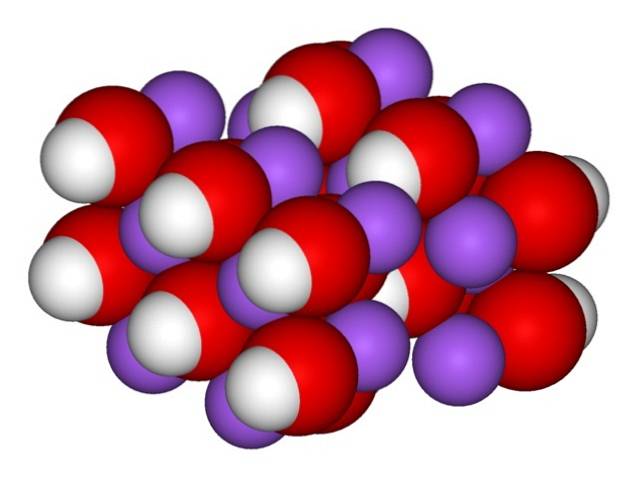
Les ions restent suffisamment cohésifs pour que le cristal de NaOH anhydre fond à 323 ºC (tant qu'il n'y a pas d'humidité dans l'environnement).
Hydrate
Les deux Na+ comme OH- Ce sont des ions que les molécules d'eau solvatent (hydratent) facilement. Cela favorise son hydratation au-dessus de l'énergie réticulaire de ses cristaux, c'est pourquoi NaOH libère beaucoup d'énergie lorsqu'il entre en contact avec l'eau..
Cependant, les cristaux anhydres peuvent héberger des molécules d'eau non dissoutes; c'est-à-dire que l'hydroxyde de sodium peut former de nombreux hydrates, NaOH nHdeuxO. La molécule d'eau peut bien former une liaison hydrogène avec l'OH- (HOH-OH-), ou coordonner avec le Na+ (N / A+-Ohdeux).
En fonction du rapport molaire entre NaOH et HdeuxOu, monohydrates (NaOHHdeuxO), dihydrates (NaOH 2HdeuxO), trihémidrates (NaOH 3,5HdeuxO), tétrahydrates (NaOH 4HdeuxO), heptahydrates (NaOH 7HdeuxO), et plus.
Chacun de ces hydrates peut cristalliser à partir d'une solution aqueuse de NaOH avec différents pourcentages massiques et à différentes températures. Par conséquent, NaOH présente un diagramme de solubilité dans l'eau compliqué..
De manière générale, les cristaux d'hydrates sont moins denses et ont des points de fusion inférieurs. En effet, les molécules d'eau «gênent» les interactions entre Na+ et OH-, ajouter des forces dipôle-dipôle au détriment des attractions ioniques.
Proprietes physiques et chimiques
Des noms
Nom préféré IUPAC: hydroxyde de sodium. Autres noms: soude caustique, ascarite (moins courante)
Masse molaire
39,9971 g / mol
Apparence
Solide ou cristaux blancs, séreux ou opaques.
Point de fusion
323 ºC
Point d'ébullition
1 388 ºC
Solubilité dans l'eau
1000 g / L à une température de 25 ° C Cela montre combien il peut se dissoudre dans l'eau..
Leurs solutions aqueuses sont visqueuses, avec une valeur de viscosité environ quatre-vingts fois celle de l'eau, et elles dégagent beaucoup de chaleur au début. Si vous êtes en contact avec eux, ils rendent la peau glissante, en raison de la saponification des acides gras de la peau..
Basicité (pKb)
- 0,56
pH
Une solution à 5% p / p dans l'eau a un pH proche de 14
Indice de réfraction (nD)
À une longueur d'onde de 580,4 nm: 1 433 à 320 ºC et 1 421 à 420 ºC.
Stabilité
Les récipients qui le contiennent doivent être fermés hermétiquement pour éviter la formation de carbonate de sodium. Cela est dû à sa forte hygroscopicité, qui l'amène à absorber l'humidité de son environnement et sa teneur en CO.deux.
Décomposition
Lorsqu'il est chauffé jusqu'à décomposition, il émet de la fumée d'oxyde de sodium.
Point d'auto-inflammation
Ce n'est pas inflammable
Viscosité
4,0 cPois à 350 ºC
Chaleur de vaporisation
175 kJ / mol à 1388 ºC
Tension superficielle
74,35 dynes / cm dans une solution à 2,72% p / p dans l'eau à 18 ºC.
Réactivité
Avec des acides
Réagit avec les acides minéraux organiques et inorganiques, créant de l'eau et le sel correspondant. Dans le cas de l'acide sulfurique, la réaction est exothermique.
2 NaOH + HdeuxSW4 => NadeuxSW4 + 2 heuresdeuxOU ALORS
Aux oxydes d'acide
Réagit avec le dioxyde de soufre, par exemple, en donnant un sel de sulfite et de l'eau:
2 NaOH + SOdeux => NadeuxSW3 + HdeuxOU ALORS
Avec des métaux
Ses solutions aqueuses réagissent avec certains métaux pour produire des sels de sodium complexes. Par exemple, sa réaction avec le zinc donne naissance à un zincate de sodium:
Zn + 2 NaOH + 2 HdeuxO => Nadeux[Zn (OH)4] + Hdeux
La synthèse
L'hydroxyde de sodium est synthétisé principalement par deux méthodes: l'utilisation du carbonate de sodium, utilisé initialement, et l'électrolyse du chlorure de sodium, actuellement de plus en plus utilisé dans l'industrie..
Réaction du carbonate de sodium et de l'hydroxyde de calcium
Le carbonate de sodium réagit avec l'hydroxyde de calcium dans un processus appelé caustification:
Ca (OH)deux + N / AdeuxCO3 => CaCO3 + NaOH
Le carbonate de calcium précipite, laissant de l'hydroxyde de sodium dans le surnageant, qui est concentré par évaporation.
Le carbonate de sodium provient auparavant du procédé Solvay:
2 NaCl + CaCO3 => NadeuxCO3 + CaCldeux
Électrolyse du chlorure de sodium
L'électrolyse du chlorure de sodium, présent dans la saumure, produit de l'hydrogène gazeux, du chlorure gazeux et de l'hydroxyde de sodium en solution aqueuse:
2 Nacl + 2 HdeuxO => Hdeux + Cldeux + 2 NaOH
La chambre électrolytique se compose d'un compartiment où se trouve l'anode (+), en titane métallique, et d'un endroit où la saumure est placée. Ce compartiment est séparé du compartiment cathodique (-) par une membrane poreuse..
La réaction suivante se produit au niveau de l'anode:
2 cl- => Cldeux + 2 e- (oxydation)
Pendant ce temps, cette réaction se produit à la cathode:
2 heuresdeuxO + 2 e- => Hdeux + Oh- (réduction)
Sodium (Na+) diffuse du compartiment anodique au compartiment cathodique, à travers la membrane qui les sépare, formant de l'hydroxyde de sodium.
Applications
Produits de nettoyage
L'hydroxyde de sodium est utilisé pour fabriquer des savons et des détergents utilisés à la maison et en entreprise. La combinaison d'hydroxyde de sodium et de chlore produit de l'eau de Javel, utilisée pour laver les vêtements blancs.
Il élimine également l'accumulation de graisse dans les drains, produisant son élimination par sa conversion en savons grâce au processus de saponification. Cela permet d'éliminer le blocage des tuyaux des maisons et autres bâtiments.
Produits pharmaceutiques et médicaments
L'hydroxyde de sodium est utilisé pour fabriquer des analgésiques courants, tels que l'aspirine. Aussi des médicaments à action anticoagulante qui bloquent la formation de caillots sanguins et des médicaments pour réduire l'hypercholestérolémie.
Processus énergétiques
L'hydroxyde de sodium est utilisé dans la fabrication de piles à combustible qui fonctionnent comme des batteries pour produire de l'électricité pour une variété d'applications, y compris le transport. Les résines époxy, fabriquées avec l'intervention de l'hydroxyde de sodium, sont utilisées dans les éoliennes.
Traitement de l'eau
L'hydroxyde de sodium est utilisé pour neutraliser l'acidité de l'eau et contribuer à l'élimination des métaux lourds de celle-ci. Il est également utilisé pour la production d'hypochlorite de sodium, un désinfectant de l'eau.
L'hydroxyde de sodium est mis à réagir avec du sulfate d'aluminium pour former de l'hydroxyde d'aluminium: un agent floculant utilisé dans les usines de traitement des eaux pour augmenter la sédimentation des particules, produisant leur clarification..
Fabrication du papier
L'hydroxyde de sodium est utilisé avec le sulfure de sodium dans le traitement du bois pour obtenir de la cellulose, sous une forme presque pure, qui forme la base du papier. Il est également utilisé dans le recyclage du papier, car en aidant à séparer l'encre, il lui permet d'être réutilisé.
Fabrication industrielle
L'hydroxyde de sodium est utilisé dans la fabrication de rayonne, d'élasthanne, d'explosifs, de résines époxy, de verre et de céramique. Il est utilisé dans l'industrie textile pour fabriquer des teintures et traiter les tissus de coton.
Dans les usines de traitement de la canne à sucre, l'hydroxyde de sodium à basse température est utilisé pour la production d'éthanol à partir de la bagasse de canne à sucre.
Des risques
L'hydroxyde de sodium est un composé hautement corrosif, il peut donc provoquer, par contact avec la peau, des brûlures, des cloques et même des cicatrices permanentes.
Au contact des yeux, il peut provoquer de graves brûlures, un gonflement, des douleurs, une vision trouble et, dans les cas graves, une cécité permanente..
Avaler de l'hydroxyde de sodium peut provoquer des brûlures aux lèvres, à la langue, à la gorge, à l'œsophage et à l'estomac. Les symptômes courants comprennent les nausées, les vomissements, les crampes d'estomac et la diarrhée..
Bien que l'inhalation d'hydroxyde de sodium soit rare et ne puisse se produire qu'en raison de la présence de poussière du composé dans l'air ou de la formation d'un brouillard qui le contient, elle produit une irritation des poumons..
En cas d'exposition chronique, cela peut provoquer un œdème pulmonaire et un essoufflement sévère, ce qui constitue une urgence médicale..
Les références
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2019). Hydroxyde de sodium. Récupéré de: en.wikipedia.org
- Centre national d'information sur la biotechnologie. (2019). Hydroxyde de sodium. Base de données PubChem. CID = 14798. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Éléments américains. (2019). Solution d'hydroxide de sodium. Récupéré de: americanelements.com
- Faits sur la sécurité chimique. (2019). Hydroxyde de sodium. Récupéré de: Chemicalsafetyfacts.org
- NJ Health. (2015). Hydroxyde de sodium. [PDF]. Récupéré de: nj.gov
- Centre canadien d'hygiène et de sécurité au travail. (2019). Fiches d'information Réponses SST: hydroxyde de sodium. Récupéré de: ccohs.ca
- Ausetute. (s.f.). Production d'hydroxyde de sodium et de chlore par électrolyse. Récupéré de: ausetute.com.au


Personne n'a encore commenté ce post.