
Structure de l'hypochlorite de potassium (KOCl), propriétés
le hypochlorite de potassium C'est le sel de potassium de l'acide hypochloreux. C'est aussi un sel ternaire de potassium, d'oxygène et de chlore et constitue un composé inorganique. Sa formule chimique est KOCl, ce qui signifie que le cation K se trouve dans le solide ionique.+ et l'anion OCl- dans un rapport stoechiométrique 1: 1.
De leurs composés homologues (LiOCl, NaOCl, Ca (OCl)deux) est peut-être le moins utilisé et le moins connu dans la culture chimique et pragmatique. Tous ces sels ont le dénominateur commun de l'anion hypochlorite (OCl-), ce qui leur confère leurs principales caractéristiques en tant qu'agent de blanchiment.
L'histoire de l'hypochlorite de potassium et ses propriétés physico-chimiques sont similaires à celles du sel d'hypochlorite de sodium. Il a été initialement produit en 1789 par Claude Louis Berthollet à Javel, Paris. La réaction de l'auteur qui a conduit à la synthèse dudit composé est exprimée par l'équation chimique suivante:
Cldeux + 2KOH => KCl + KClO + HdeuxOU ALORS
Selon l'équation, le chlore moléculaire réagit avec l'hydroxyde de potassium (ou potasse caustique), réduisant et oxydant les atomes de chlore. Ceci peut être vérifié en comparant le nombre d'oxydation de Cl dans KCl (-1) avec celui de Cl dans KClO (+1).
Index des articles
- 1 Structure chimique
- 2 Nomenclature
- 3 propriétés
- 3.1 Masse molaire
- 3.2 Apparence
- 3.3 Densité
- 3.4 Point de fusion
- 3.5 Point d'ébullition
- 3.6 Solubilité dans l'eau
- 3.7 Réactivité
- 4 utilisations
- 5 Références
Structure chimique

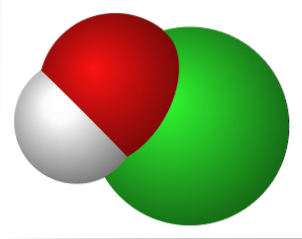
L'image du haut représente les interactions électrostatiques entre le cation K+ et l'anion OCl- (avec de l'oxygène portant une charge formelle négative).
Ces ions ont les mêmes proportions stoechiométriques (1: 1) et leurs forces non directionnelles forment un arrangement cristallin, où K+ est positionné au plus près de l'atome O.
Bien qu'il n'y ait pas d'études décrivant le système cristallin de KOCl (cubique, orthorhombique, monoclinique, etc.), il suffit de le visualiser comme une grande sphère de K+ attiré par l'ion de géométrie linéaire de l'OCl-.
On peut penser que, contrairement au NaOCl, KOCl forme des cristaux avec une énergie de réseau plus faible, car K+ est plus grand que Na+ par rapport à OCl-. Cette plus grande dissemblance entre leurs rayons ioniques rend les forces électrostatiques présentes entre eux moins efficaces..
En outre, on peut s'attendre à ce que les performances en solution aqueuse de ce sel soient similaires à celles du NaOCl. Entouré d'eau, le K+ -plus volumineux - il doit avoir une sphère d'hydratation supérieure à celle de Na+. Sinon, les propriétés de ses solutions (couleur, odeur et pouvoir blanchissant) ne diffèrent pas de manière significative..
Nomenclature
Pourquoi le sel d'hypochlorite de potassium est-il ainsi nommé? Pour y répondre, il faut recourir à la nomenclature des sels ternaires régie par l'IUPAC. Tout d'abord, comme le potassium n'a que la valence +1, il n'est pas nécessaire de l'écrire; par conséquent, il est ignoré. Alors, n'écrivez pas l'hypochlorite de potassium (I).
L'acide chlorique a la formule HClO3. Lorsque le nombre d'oxygène diminue, l'atome de chlore gagne plus d'électrons; c'est-à-dire qu'il a des indices d'oxydation moins positifs. Par exemple, dans cet acide, Cl a un indice d'oxydation de +5.
Comme dans HClO, Cl a un indice d'oxydation de +1 qui, en plus, a deux unités en moins d'atomes d'O (1 au lieu de 3 par rapport à HClO3), son suffixe de nom devient -oso. De même, puisque +1 est le plus petit nombre d'oxydation que l'atome Cl peut atteindre, le préfixe -hypo est ajouté..
Ainsi, HClO est appelé acide hypochloreux. Cependant, KOCl est son sel de potassium et pour les nombres d'oxydation de Cl inférieurs à +5, le suffixe -oso est remplacé par le suffixe -ito. Sinon, pour les nombres d'oxydation égaux ou supérieurs à +5, le suffixe est remplacé par -ate. Donc le nom reste hypochlorite de potassium.
Propriétés
Masse molaire
90,55 g / mol.
Apparence
C'est un liquide légèrement grisâtre.
Densité
1,16 g / cm3
Point de fusion
-2 ° C (28 ° F; 271 ° K). Ce bas point de fusion, malgré le caractère ionique de ses liaisons, démontre la faible énergie de réseau cristallin de son solide pur, un produit des charges monovalentes de K+ et l'OCl-, et contrairement à ses rayons ioniques.
Point d'ébullition
102 ° C (216 ° F; 375 ° K). C'est seulement légèrement plus élevé que l'eau pure.
Solubilité dans l'eau
25% p / v, ce qui est une valeur raisonnable étant donné la facilité des molécules d'eau à solvater les ions K+.
Les solutions aqueuses d'hypochlorite de potassium ont des qualités de blanchiment, tout comme celles de NaOCl. Il est irritant et peut causer de graves dommages au contact de la peau, des yeux et des muqueuses. De même, son inhalation produit une irritation bronchique, une détresse respiratoire et un œdème pulmonaire..
Réactivité
-L'hypochlorite de potassium est un puissant agent oxydant qui n'est pas considéré comme un élément provoquant des incendies ou des explosions. Cependant, il est capable de se combiner avec différents éléments chimiques pour produire des composés inflammables et explosifs..
-Au contact de l'urée, il peut former du NCl3, un composé hautement explosif. Lorsqu'il est chauffé ou mis en contact avec des acides, il produit une fumée de chlorure hautement toxique. Réagit vigoureusement avec le charbon lors d'une réaction potentiellement explosive.
-Il se combine avec l'acétylène pour former le chloroacétylène explosif. De même, sa réaction avec la matière organique, l'huile, les hydrocarbures et les alcools peut provoquer des explosions. Sa réaction avec le nitrométhane, le méthanol et l'éthanol peut devenir explosive.
-Il se décompose en libérant de l'oxygène, un processus qui peut être catalysé par la rouille ou par le récipient métallique qui le contient..
-L'hypochlorite de potassium doit être conservé au froid pour éviter la formation de chlorate de potassium, dont la décomposition peut même être explosive..
Applications
-Utilisé comme désinfectant de surface et d'eau potable.
-La dégradation dans les sols de l'hypochlorite de potassium en chlorure de potassium a suggéré son utilisation dans les cultures comme source de potassium, un élément nutritionnel primaire pour les plantes..
-Certaines entreprises ont suggéré son application comme substitut du NaOCl en tant qu'agent de blanchiment, affirmant les propriétés bénéfiques de l'ion K+ contre l'impact environnemental causé par Na+.
Les références
- Enviro Tech, la solution sans sodium. [PDF]. Extrait le 29 mai 2018 de: envirotech.com
- PubChem. (2018). Hypochlorite de potassium. Extrait le 29 mai 2018 de: pubchem.ncbi.nlm.nih.gov
- Wikipédia. (2018). Hypochlorite de potassium. Récupéré le 29 mai 2018 sur: en.wikipedia.org
- Livre chimique. (2017). Hypochlorite de potassium. Extrait le 29 mai 2018 de: Chemicalbook.com
- Whitten, Davis, Peck et Stanley. Chimie. (8e éd.). Apprentissage CENGAGE, p 873, 874.



Personne n'a encore commenté ce post.