
Structure, fonction et valeurs normales de l'immunoglobuline D

La immunoglobuline D (IgD), découverte en 1965, est une immunoglobuline de surface qui se trouve (avec l'IgM) dans la membrane des lymphocytes B (mIgD) avant leur activation.
Il a sa fonction de récepteur initial des antigènes. L'IgD est également libre dans le plasma grâce à sa sécrétion (sIgD). Il a un poids moléculaire de 185 000 Daltons et représente environ 1% des immunoglobulines d'un organisme.
Index des articles
- 1 Que sont les immunoglobulines?
- 2 Structure
- 3 Fonction et maladies
- 3.1 sIgD
- 3,2 mIgD
- 3.3 Lymphocytes B
- 3.4 Système immunitaire-inflammatoire
- 4 Valeurs normales
- 4.1 Concentration sérique
- 4.2 Valeurs sanguines
- 5 Références
Que sont les immunoglobulines?
Les immunoglobulines ou anticorps sont des glycoprotéines globulaires complexes hautement spécifiques synthétisées par les lymphocytes B, cellules responsables de la réponse immunitaire dans le corps des animaux..
Les immunoglobulines interagissent avec des molécules que le corps identifie comme non-soi ou antigènes. Toute substance capable d'activer la réponse immunitaire dans le corps est appelée un antigène..
La famille des molécules d'anticorps Ig comprend celles circulant dans le plasma sanguin et celles à la surface des lymphocytes B avant leur activation..
Il existe cinq types d'immunoglobulines: IgG, IgD, IgE, IgA et IgM (identifiées chez l'homme, la souris, le chien, les reptiles, le poisson, entre autres), qui diffèrent structurellement par leurs régions constantes dans la chaîne lourde. Ces différences leur confèrent des propriétés fonctionnelles particulières.
Les anticorps agissent comme des capteurs spécifiques pour les antigènes. Avec ceux-ci, ils forment des complexes qui déclenchent une cascade de réactions typiques du système immunitaire. Les étapes générales de ce processus sont: la reconnaissance, la différenciation de lymphocytes spécifiques et enfin le stade effecteur.
Structure
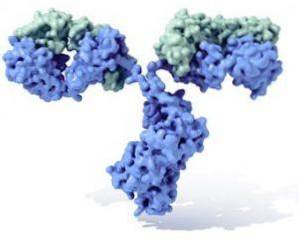
Tous les anticorps sont des molécules polypeptidiques complexes en forme de "Y". Ils sont constitués de quatre chaînes polypeptidiques, dont deux chaînes légères (courtes) identiques d'environ 214 acides aminés chacune, et les deux autres chaînes lourdes (longues) également identiques l'une à l'autre, deux fois plus d'acides aminés. Une liaison disulfure relie une chaîne légère à une chaîne lourde.
Les deux types de chaînes ont des régions constantes (caractéristiques du type d'anticorps et de l'espèce à laquelle appartient l'organisme), où la séquence d'acides aminés est répétée d'une molécule à l'autre, et ils ont également des régions variables d'environ 100 acides aminés dans longueur..
Un pont disulfure (liaison de type covalent) relie chaque chaîne légère à une chaîne lourde et à son tour une ou deux de ces liaisons peuvent joindre les deux chaînes lourdes.
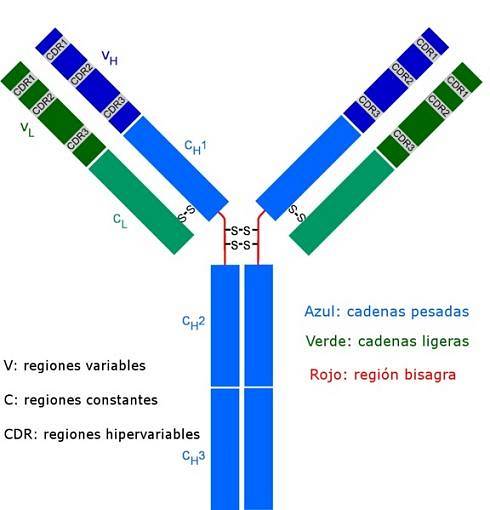
Ces sites sont ceux qui se lient comme un gant à une région particulière de l'antigène, de l'épitope ou du déterminant antigénique spécifique. La stabilisation de cette interaction se fait grâce à de nombreuses liaisons non covalentes.
Ces séquences CDR sont très variables parmi les anticorps, générant une spécificité pour différents types d'antigènes..
Concernant les particularités de l'immunoglobuline D, on sait qu'elle présente une grande diversité chez les vertébrés. D'une manière générale, il est composé de deux chaînes lourdes delta et de deux chaînes légères. L'IgD est soit libre dans le sérum, soit liée aux lymphocytes B via un récepteur Fc..
Fonction et maladies
Étant donné que les IgD ont été préservées de manière évolutive des poissons cartilagineux (qui peuplaient la planète il y a environ 500 millions d'années) aux humains, on pense qu'elles remplissent des fonctions immunitaires vitales.
Malgré cela, elle a été la moins étudiée des immunoglobulines, pour lesquelles les fonctions spécifiques de la sIgD dans le sérum ne sont pas encore connues exactement, alors que plusieurs fonctions ont été proposées pour la mIgD.
sIgD
L'une des causes de l'intérêt récent pour l'étude de la sIgD a été la découverte de taux élevés de cette Ig chez certains enfants souffrant de fièvre périodique. À son tour, un autre facteur d'intérêt est son utilité dans la surveillance des myélomes..
On pense que la SIgD joue un rôle dans le sang, les sécrétions muqueuses et à la surface des cellules effectrices immunitaires innées, telles que les basophiles.
Ils sont très réactifs contre les agents pathogènes du système respiratoire et leurs produits d'excrétion. Il a été rapporté que l'IgD augmente l'immunité muqueuse, grâce à son effet sur les bactéries et les virus présents.
mIgD
Concernant la mIgD, elle est considérée comme un récepteur antigénique membranaire des lymphocytes B, ce qui favoriserait la maturation cellulaire. À son tour, on pense qu'il s'agit d'un ligand pour les récepteurs IgD dans l'immunorégulation des cellules T auxiliaires..
Lymphocytes B
On pense que les lymphocytes B producteurs d'IgD représentent une lignée cellulaire particulière appelée lymphocytes B-1. Ce sont des lymphocytes auto-réactifs qui ont échappé à la délétion clonale.
Les autoanticorps générés par ces lymphocytes réagissent avec l'acide désoxyribonucléique ou l'ADN (simple et double brin), avec les récepteurs cellulaires, les membranes cellulaires des globules rouges et le tissu épithélial..
C'est ainsi qu'ils génèrent des maladies auto-immunes, telles que le lupus érythémateux disséminé, la myasthénie gravis, anémie hémolytique auto-immune et purpura de thrombopénie idiopathique.
Système immuno-inflammatoire
On sait également que les IgD sont impliquées dans l'orchestration d'un système qui interfère entre les systèmes immunitaire et inflammatoire: des concentrations élevées d'IgD sont liées à des troubles auto-inflammatoires (syndrome d'hyperimmunoglobulémie D, HIDS ou hyper-IgD).
Par exemple, chez les patients atteints de maladies auto-immunes, telles que la polyarthrite rhumatoïde, des valeurs élevées de la sIgD et de la mIgD sont trouvées. On pense donc que cette condition contribue à la pathogenèse de la maladie.
Les fonctions possibles de cet anticorps dans les cellules mononucléées du sang périphérique (PBMC) de ces patients sont actuellement à l'étude. Tout cela a conduit à considérer que les IgD pourraient être une cible immunothérapeutique potentielle dans le traitement de la polyarthrite rhumatoïde.
Valeurs normales
Le sIgD chez les individus normaux varie considérablement, ce qui a rendu difficile l'établissement d'un intervalle de référence précis pour leurs concentrations normales. Certaines études ont montré que cette variation est particulièrement influencée par:
- La sensibilité de la technique de détection appliquée - à la fois par radioimmunodosages (RIA), par immunoessais enzymatiques (EIA) et la plus couramment utilisée dans les laboratoires cliniques qui est la radioimmunodiffusion (RID)-.
- L'absence d'une seule méthode universelle stipulée pour la détection des IgD.
- Facteurs héréditaires, race, âge, sexe, état de grossesse, statut tabagique, entre autres
Certains spécialistes considèrent même que l'analyse de routine des IgD n'est pas justifiée, car son rôle spécifique est loin d'être élucidé et les coûts de son analyse en laboratoire clinique sont élevés. Il ne serait justifié que dans les cas de patients présentant une IgD monoclonale sérique ou suspectés d'avoir un HIDS.
Concentration sérique
Par contre, on sait que la sIgD a généralement une concentration sérique inférieure à celle des IgG, IgA et IgM, mais supérieure à la concentration d'IgE..
De plus, du fait qu'elle a une demi-vie de 2 à 3 jours, la concentration plasmatique est inférieure à 1% de l'immunoglobuline totale dans le sérum. Certaines recherches indiquent qu'il représente 0,25% des immunoglobulines sériques totales.
Valeurs sanguines
Entre los valores reportados de sIgD en sangre, en recién nacidos ha sido de 0,08 mg/L (determinada por RIA), en infantes y adultos varía desde valores indetectables hasta 400 mg/L (dependiente de la edad y de particulares de cada individu).
Chez les adultes normaux, ils ont été rapportés comme des moyennes normales 25; 35; 40 et 50 mg / L. En termes généraux, la concentration sérique moyenne chez les adultes en bonne santé a été rapportée à 30 mg / L (déterminée par RID)..
Cependant, comme indiqué dans cet article, de nombreux facteurs empêchent d'établir une plage de valeurs normales standard..
Les références
- Chen, K. et Cerutti, A. (2011). La fonction et la régulation de l'immunoglobuline D. Opinion actuelle en immunologie, 23 (3), 345-52.
- Harfi, A. H. et Godwin, J.T. (1985). Niveaux sériques normaux d'IgG, IgA, IgM, IgD et IgE en Arabie Saoudite. Annals of Saudi Medicine, Vol 5, No 2.99-104. doi: 10.5144 / 0256-4947.1985.99
- Josephs, S.H. et Buckley, R.H. (1980). Concentrations sériques d'IgD chez les nourrissons, les enfants et les adultes normaux et chez les patients présentant des IgE élevées. The Journal of Pediatrics, vol. 96, n ° 3, pp 417-420.
- Vladutiu, A.O. (2000). Immunoglobuline D: propriétés, mesure et pertinence clinique. Immunologie de laboratoire clinique et diagnostique, 7(2), 131-40.
- Voet, J.G. et Voet, W.P.D. (2005). Fondamentaux de la biochimie: Lyfe au niveau moléculaire. Wiley. pp 1361.
- Wu, Y., Chen, W., Chen, H., Zhang, L., Chang, Y., Yan, S., Dai, X., Ma, Y., Huang, Q. et Wei, W. ( 2016). L'immunoglobuline D sécrétée élevée a amélioré l'activation des cellules mononucléées du sang périphérique dans la polyarthrite rhumatoïde. PloS un, 11 (1). doi: 10.1371 / journal.pone.0147788


Personne n'a encore commenté ce post.