
Formule et unités de la loi des gaz parfaits, applications, exemples
La loi des gaz parfaits est une équation d'état qui décrit une relation entre les fonctions d'état associées au gaz parfait; comme la température, la pression, le volume et le nombre de moles. Cette loi permet d'étudier les systèmes gazeux réels en les comparant à leurs versions idéalisées..
Un gaz parfait est un gaz théorique, composé de particules ponctuelles ou sphériques qui se déplacent au hasard; avec une grande énergie cinétique, où la seule interaction entre eux est des chocs complètement élastiques. De plus, ils sont conformes à la loi des gaz parfaits.

À pression et température standard (STP): 1 atm de pression et une température de 0 ºC, la plupart des gaz réels se comportent qualitativement comme des gaz parfaits; tant que leurs densités sont faibles. De grandes distances intermoléculaires ou interatomiques (pour les gaz rares) facilitent de telles approximations..
Dans des conditions STP, l'oxygène, l'azote, l'hydrogène, les gaz rares et certains gaz sous forme composée, comme le dioxyde de carbone, se comportent comme un gaz idéal..
Le modèle de gaz parfait a tendance à échouer à des températures basses, des pressions élevées et des densités de particules élevées; lorsque les interactions intermoléculaires, ainsi que la taille des particules, deviennent importantes.
La loi des gaz parfaits est une composition de trois lois des gaz: la loi de Boyle et Mariotte, la loi de Charles et Gay-Lussac et la loi d'Avogadro..
Index des articles
- 1 Formule et unités
- 2 Qu'est-ce que la loi des gaz parfaits établit?
- 3 applications
- 3.1 Calcul de la masse volumique et de la masse molaire d'un gaz
- 3.2 Calcul du volume d'un gaz produit lors d'une réaction chimique
- 3.3 Calcul des pressions partielles des gaz présents dans un mélange
- 3.4 Volume de gaz collecté dans l'eau
- 4 Exemples de calculs
- 4.1 Exercice 1
- 4.2 Exercice 2
- 4.3 Exercice 3
- 4.4 Exercice 4
- 5 Références
Formule et unités

La loi des gaz s'exprime mathématiquement par la formule:
PV = nRT
Où P est la pression exercée par un gaz. Il est généralement exprimé avec l'unité d'atmosphère (atm), bien qu'il puisse être exprimé en d'autres unités: mmHg, pascal, bar, etc..
Le volume V occupé par un gaz est généralement exprimé en unités du litre (L). Alors que n est le nombre de moles, R la constante universelle des gaz et T la température exprimée en Kelvin (K).
L'expression la plus utilisée dans les gaz pour R est égale à 0,08206 L atm K-1Taupe-1. Bien que l'unité SI de la constante de gaz ait une valeur de 8,3145 J mol-1K-1. Les deux sont valides tant que l'on prend soin des unités des autres variables (P, T et V).
La loi des gaz parfaits est une combinaison de la loi de Boyle-Mariotte, de la loi de Charles-Gay-Lussac et de la loi d'Avogadro.
Loi Boyle-Mariotte
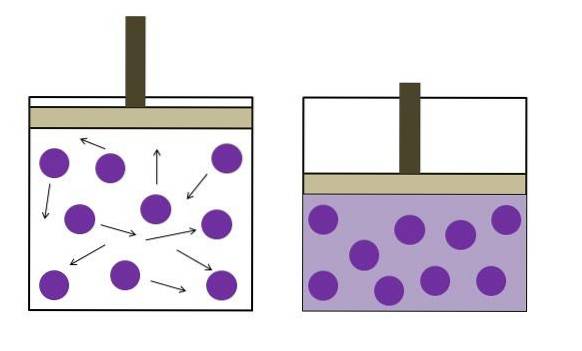
Il a été formulé indépendamment par le physicien Robert Boyle (1662) et le physicien et botaniste Edme Mariotte (1676). La loi est énoncée comme suit: à température constante, le volume d'une masse fixe d'un gaz est inversement proportionnel à la pression qu'il exerce.
PV ∝ k
En utilisant un deux-points:
P1V1 = PdeuxVdeux
Loi Charles-Gay-Lussac

La loi a été publiée par Gay-Lussac en 1803, mais elle fait référence à l'ouvrage inédit de Jacques Charles (1787). Pour cette raison, la loi est connue sous le nom de loi de Charles..
La loi stipule qu'à pression constante, il existe une relation proportionnelle directe entre le volume occupé par un gaz et sa température.
V ∝ kdeuxT
En utilisant un deux-points:
V1/ T1 = Vdeux/ Tdeux
V1Tdeux = VdeuxT1
Loi d'Avogadro
La loi a été énoncée par Amadeo Avogadro en 1811, soulignant que des volumes égaux de tous les gaz, à la même pression et température, ont le même nombre de molécules.
V1/ n1 = Vdeux/ ndeux
Que dit la loi sur les gaz parfaits?
La loi des gaz parfaits établit une relation entre quatre propriétés physiques indépendantes du gaz: la pression, le volume, la température et la quantité de gaz. Il suffit de connaître la valeur de trois d'entre eux, pour pouvoir obtenir celle du reste.
La loi établit les conditions qui indiquent quand un gaz se comporte idéalement et quand il s'éloigne de ce comportement.
Par exemple, le soi-disant facteur de compression (PV / nRT) a une valeur de 1 pour les gaz parfaits. Un écart par rapport à la valeur de 1 pour le facteur de compression indique que le comportement du gaz est loin de celui montré par un gaz parfait.
Par conséquent, une erreur serait commise lors de l'application de l'équation du gaz parfait à un gaz qui ne se comporte pas selon le modèle.
Applications
Calcul de la densité et de la masse molaire d'un gaz
L'équation de la loi des gaz parfaits peut être utilisée pour calculer la densité d'un gaz et sa masse molaire. En faisant une simple modification, on peut trouver une expression mathématique qui relie la densité (d) d'un gaz et sa masse molaire (M):
d = MP / RT
Et effacer M:
M = dRT / P
Calcul du volume d'un gaz produit lors d'une réaction chimique
La stoechiométrie est la branche de la chimie qui met en relation la quantité de chacun des réactifs présents avec les produits participant à une réaction chimique, généralement exprimée en moles..
L'utilisation de l'équation des gaz parfaits permet de déterminer le volume d'un gaz produit lors d'une réaction chimique; puisque le nombre de moles peut être obtenu à partir de la réaction chimique. Ensuite, le volume du gaz peut être calculé:
PV = nRT
V = nRT / P
En mesurant V, le rendement ou la progression de ladite réaction peut être déterminé. Lorsqu'il n'y a plus de gaz, c'est une indication que les réactifs sont complètement épuisés.
Calcul des pressions partielles des gaz présents dans un mélange
La loi des gaz parfaits peut être utilisée, avec la loi de pression partielle de Dalton, pour calculer les pressions partielles des différents gaz présents dans un mélange gazeux..
La relation s'applique:
P = nRT / V
Pour trouver la pression de chacun des gaz présents dans le mélange.
Volume de gaz collecté dans l'eau
Une réaction est effectuée qui produit un gaz, qui est collecté au moyen d'un plan expérimental dans l'eau. La pression totale du gaz plus la pression de vapeur d'eau est connue. La valeur de ce dernier peut être obtenue dans un tableau et par soustraction la pression du gaz peut être calculée.
À partir de la stoechiométrie de la réaction chimique, le nombre de moles du gaz peut être obtenu, et en appliquant la relation:
V = nRT / P
Le volume de gaz produit est calculé.
Exemples de calcul
Exercice 1
Un gaz a une densité de 0,0847 g / L à 17 ° C et une pression de 760 torrs. Quelle est sa masse molaire? Qu'est-ce que le gaz?
Nous partons de l'équation
M = dRT / P
Nous convertissons d'abord les unités de température en kelvin:
T = 17 ºC + 273,15 K = 290,15 K
Et la pression de 760 torr correspond à celle de 1 atm. Il ne vous reste plus qu'à remplacer les valeurs et à résoudre:
M = (0,0847 g / L) (0,08206 L atm K-1Taupe-1) (290,15 K) / 1 atm
M = 2,016 g / mol
Cette masse molaire peut correspondre à une seule espèce: la molécule d'hydrogène diatomique, Hdeux.
Exercice 2
On retrouve une masse de 0,00553 g de mercure (Hg) en phase gazeuse dans un volume de 520 L, et à une température de 507 K. Calculer la pression exercée par Hg. La masse molaire de Hg est de 200,59 g / mol.
Le problème est résolu en utilisant l'équation:
PV = nRT
Les informations sur le nombre de moles de Hg n'apparaissent pas; mais ils peuvent être obtenus en utilisant leur masse molaire:
Nombre de moles de Hg = (0,00553 g de Hg) (1 mole de Hg / 200,59 g)
= 2 757 10-5 taupes
Il ne reste plus qu'à résoudre P et à substituer les valeurs:
P = nRT / V
= (2 757 10-5 moles) (8,20610-deux L atm K-1Taupe-1) (507 K) / 520 L
= 2,2 10-6 au m
Exercice 3
Calculez la pression générée par l'acide chlorhydrique produit en faisant réagir 4,8 g de chlore gazeux (Cldeux) avec de l'hydrogène gazeux (Hdeux), dans un volume de 5,25 L et à une température de 310 K. La masse molaire de Cldeux est 70,9 g / mol.
H2 g) + Cl2 g) → 2 HCl(g)
Le problème est résolu en utilisant l'équation des gaz parfaits. Mais la quantité de HCl est exprimée en grammes et non en moles, donc la transformation appropriée est effectuée.
Moles de HCl = (4,8 g Cldeux) (1 mole de Cldeux/ 70,9 g Cldeux) (2 mol HCl / 1 mol Cldeux)
= 0,135 mole de HCl
Application de l'équation de la loi des gaz parfaits:
PV = nRT
P = nRT / V
= (0,135 mole de HCl) (0,08206 L atm K-1Taupe-1) (310 K) / 5,25 L
= 0,65 atm
Exercice 4
Un échantillon de 0,130 g d'un composé gazeux occupe un volume de 140 mL à une température de 70 ° C et une pression de 720 torr. Quelle est sa masse molaire?
Pour appliquer l'équation des gaz parfaits, plusieurs modifications doivent d'abord être apportées:
V = (140 ml) (1 L / 1000 ml)
= 0,14 L
En prenant le volume en litres, il faut maintenant exprimer la température en kelvin:
T = 70 ºC + 273,15 K = 243,15 K
Et enfin, il faut convertir la pression en unités d'atmosphère:
P = (720 torr) (1 atm / 760 torr)
= 0,947 atm
La première étape pour résoudre le problème consiste à obtenir le nombre de moles du composé. Pour cela, l'équation des gaz parfaits est utilisée et nous résolvons pour n:
PV = nRT
n = PV / RT
= (0,947 atm) (0,14 L) / (0,08206 L atm K-1Taupe-1) (243,15 Ko)
= 0,067 mole
Il vous suffit de calculer la masse molaire en divisant les grammes par les moles obtenues:
Masse molaire = grammes de composé / nombre de moles.
= 0,130 g / 0,067 mole
= 19,49 g / mol
Les références
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE.
- Ira N. Levine. (2014). Principes de physicochimie. Sixième édition. Mc Graw Hill.
- Glasstone. (1970). Traité de chimie physique. Deuxième édition. Aguilar.
- Mathews, C. K., Van Holde, K. E. et Ahern, K. G. (2002). Biochimie. 3était Édition. Éditeur Pearson Addison Wesley.
- Wikipédia. (2019). Gaz parfait. Récupéré de: en.wikipedia.org
- Équipe éditoriale. (2018). Loi de Boyle ou loi de Boyle-Mariotte | Lois des gaz. Récupéré de: iquimicas.com



Personne n'a encore commenté ce post.