
Caractéristiques, structure, fonctions du lysozyme
le lysozymes ce sont des enzymes hydrolytiques largement distribuées dans la nature capables d'hydrolyser les liaisons glycosidiques du peptidoglycane dans la paroi des bactéries. Ils sont présents dans les plantes et les animaux et fonctionnent comme un mécanisme de défense contre les infections bactériennes.
La découverte de ces enzymes remonte à 1922, quand Alexander Fleming s'est rendu compte qu'il y avait une protéine qui avait la capacité catalytique de lyser les bactéries dans certains tissus et sécrétions humains..
Grâce à sa facilité d'obtention et à sa petite taille, le lysozyme a été l'une des premières enzymes séquencées et dont la structure a été déterminée par rayons X. Actuellement, il est utilisé comme système modèle en chimie, enzymologie, cristallographie et biologie moléculaire des protéines..
Le lysozyme est une enzyme «bactériolytique» qui se spécialise dans l'hydrolyse des liaisons β-1,4 glycosidiques qui se forment entre l'acide N-acétylmuramique et la N-acétylglucosamine présente dans la paroi cellulaire du peptidoglycane qui est particulièrement exposée dans les bactéries Gram positives.
Il a diverses fonctions, à la fois digestives et immunologiques, dans tous les organismes où il est exprimé et utilisé comme ressource biotechnologique à des fins diverses..
Index des articles
- 1 Fonctionnalités
- 2 Types de lysozymes chez les animaux et leurs caractéristiques
- 2.1 Lysozymes de type C
- 2.2 Lysozymes de type G
- 2.3 Lysozymes de type I
- 3 Structure
- 4 fonctions
- 5 Références
Caractéristiques
Les lysozymes sont exprimés par les principaux groupes d'organismes vivants de la planète, mais ils sont particulièrement abondants chez les animaux et c'est à partir de ceux-ci qu'ils ont été purifiés et étudiés..
Chez l'homme, le lysozyme se trouve en concentrations élevées dans différents liquides et tissus tels que le foie, le cartilage, la salive, le mucus et les larmes. Il est exprimé par les cellules hématopoïétiques et se trouve également dans les granulocytes, les monocytes et les macrophages, ainsi que dans d'autres cellules précurseurs de la moelle osseuse..
Les lysozymes d'origine végétale hydrolysent des substrats similaires à ceux utilisés par d'autres enzymes étroitement apparentées connues sous le nom de chitinases, pour cette raison, ils peuvent également hydrolyser les liaisons de la chitine, bien qu'avec moins d'efficacité.
Types de lysozymes chez les animaux et leurs caractéristiques
Au moins trois types de lysozymes ont été décrits dans le règne animal:
-Lysozymes de type C ("C" à partir de "c"ou" conventionnelchicken ", Qu'est-ce que le poulet signifie en anglais)
-Lysozymes de type G ("G" de "goose”, Ce qui signifie goose en anglais) et
-Lysozymes de type I ("I" de "jenvertébrés »)
Les trois classes de lysozymes diffèrent les unes des autres en ce qui concerne leurs séquences d'acides aminés, leurs caractéristiques biochimiques et leurs propriétés enzymatiques..
Lysozymes de type C
Ces lysozymes sont considérés comme les enzymes «modèles» de cette famille, car ils ont servi de modèle pour les études de structure et de fonction. Ils sont connus sous le nom de type "C" de l'anglais "poulet«Puisqu'ils ont été isolés pour la première fois du blanc des œufs de poule.
Dans cette classe se trouvent les lysozymes produits par la plupart des vertébrés, en particulier les oiseaux et les mammifères. Il comprend également des enzymes présentes dans certains arthropodes tels que les lépidoptères, les diptères, certains arachnides et crustacés.
Ce sont de petites enzymes car elles ont un poids moléculaire qui ne dépasse pas 15 kDa. Ce sont des protéines basiques avec des points isoélectriques élevés.
Lysozymes de type G
Le premier lysozyme de ce type a été identifié dans le blanc d'oeuf d'oie et est présent chez de nombreuses espèces d'oiseaux comme les poulets, les cygnes, les autruches, les casoars et autres..
Dans certains cas, les lysozymes de type G sont plus abondants que les lysozymes de type C dans les blancs d'œufs de certains oiseaux, tandis que dans d'autres, c'est l'inverse, les lysozymes de type C sont plus abondants..
Ces lysozymes sont également présents dans les mollusques bivalves et chez certains tuniciers. Elles sont légèrement plus grosses que les protéines de type C, mais leur poids moléculaire ne dépasse généralement pas 25 kDa.
Lysozymes de type I
Ces lysozymes sont principalement présents chez les animaux invertébrés. Sa présence a été déterminée chez les annélides, les échinodermes, les crustacés, les insectes, les mollusques et les nématodes, et est absente chez les mammifères et autres vertébrés..
Ils ont plus de points isoélectriques acides que ceux des protéines de type C et de type G.
Structure
Les trois types d'enzymes animales décrits dans la section précédente ont des structures tridimensionnelles assez similaires..
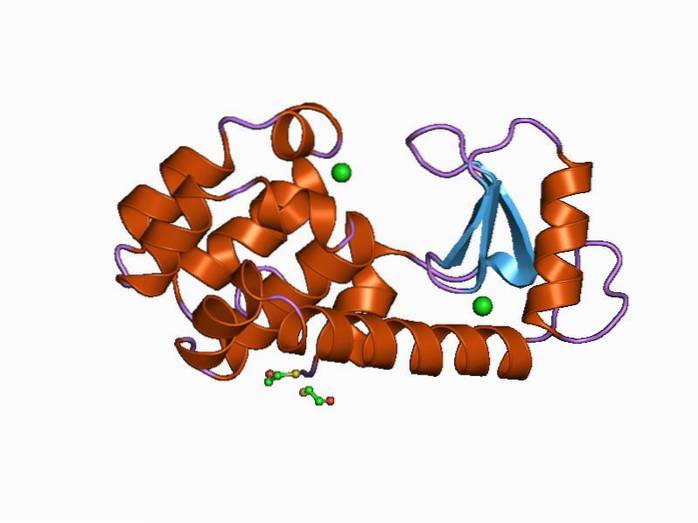
Le lysozyme humain est un lysozyme de type C et a été la première de ces enzymes à être étudiée et caractérisée structurellement. C'est une petite protéine de 130 résidus d'acides aminés et est codée par un gène situé sur le chromosome 12, qui a 4 exons et 3 introns..
Sa structure est divisée en deux domaines: l'un connu sous le nom de domaine α et un autre comme domaine β. Le domaine α est composé de quatre hélices alpha et le domaine β est constitué d'une feuille β antiparallèle et d'une grande boucle.
Le site catalytique de l'enzyme est situé dans la fente qui se forme entre les deux domaines et pour se lier au substrat, il contient des résidus d'acide glutamique et d'acide aspartique. De plus, il possède au moins six "sous-sites" appelés A, B, C, D, E et F, capables de se lier à six résidus de sucre consécutifs.
Caractéristiques
Le lysozyme a non seulement des fonctions physiologiques dans la protection et la lutte contre les infections bactériennes dans les organismes qui l'expriment, mais, comme mentionné, il a été très utile comme enzyme modèle du point de vue chimique, enzymatique et structurel..
Dans l'industrie d'aujourd'hui, il est reconnu comme un bactéricide puissant et est utilisé pour la conservation des aliments et des médicaments.
Grâce à la réaction que ces enzymes catalysent, elles peuvent agir sur différentes populations bactériennes et altérer la stabilité de leurs parois, ce qui se traduit plus tard par une lyse cellulaire..
En conjonction avec d'autres enzymes similaires, les lysozymes peuvent agir à la fois sur les bactéries à Gram positif et à Gram négatif, de sorte qu'ils peuvent être considérés comme des parties du système antibactérien «immunitaire» de différentes classes d'organismes.
Dans les globules blancs présents dans le sang des mammifères, ces enzymes ont des fonctions importantes dans la dégradation des microorganismes envahisseurs, ce qui les rend indispensables au système immunitaire des humains et des autres mammifères..
Les lysozymes des plantes remplissent essentiellement les mêmes fonctions que chez les animaux qui les expriment, car ils constituent la première ligne de défense contre les bactéries pathogènes..
Les références
- Callewaert, L. et Michels, W. (2010). Lysozymes dans le règne animal. J. Biosci., 35(1), 127-160.
- Merlini, G. et Bellotti, V. (2005). Lysozyme: une molécule paradigmatique pour l'étude de la structure, de la fonction et du mauvais repliement des protéines. Clinique Chimica Acta, 357, 168-172.
- Mir, A. (1977). Lysozyme: une brève revue. Journal médical de troisième cycle, 53, 257-259.
- Sahoo, N. R., Kumar, P., Bhusan, B., Bhattacharya, T. K., Dayal, S., et Sahoo, M. (2012). Lysozyme dans le bétail: un guide de sélection pour la maladie. Journal of Animal Science Advances, deux(4), 347-360.
- Wohlkönig, A., Huet, J., Looze, Y., et Wintjens, R. (2010). Relations structurelles dans la superfamille des lysozymes: preuves significatives des motifs de signature de la glycoside hydrolase. PLoS One, 5(11), 1-10.



Personne n'a encore commenté ce post.