
Fond de teint MIO moyen, préparation et utilisations
le moitié MIO est un test biochimique utilisé pour aider à l'identification d'espèces de bactéries appartenant à la famille des Enterobacteriaceae. Il est assez nutritif et est composé de glucose, d'extrait de levure, de peptone, de triptein, de chlorhydrate de L-ornithine, de violet de bromocrésol et d'agar.
La signification de son acronyme (MIO) décrit chacun des paramètres observables dans ce milieu; motilité, indole et ornithine. La motilité est la capacité du micro-organisme à se déplacer en raison de la présence de flagelles. Pour que cette propriété soit observée, la consistance du milieu doit être semi-solide, donc la préparation contient moins de gélose..
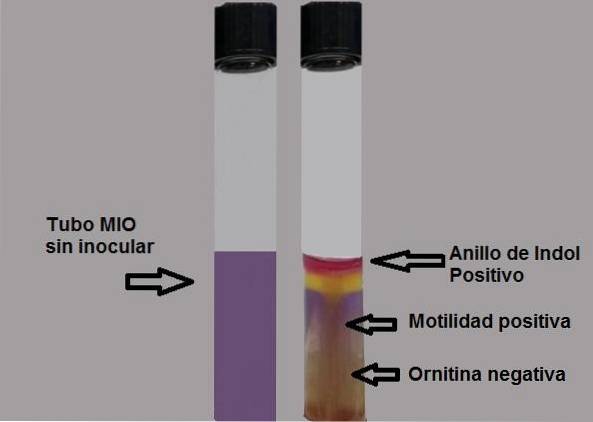
La production d'indole montre la présence de l'enzyme tryptophanase qui agit sur l'acide aminé tryptophane, nécessitant l'utilisation d'un réactif révélateur pour rendre visible la production d'indole..
Enfin, l'ornithine détermine si la bactérie est capable de décarboxyler l'acide aminé, c'est-à-dire si elle contient l'enzyme orinithine décarboxylase.
Index des articles
- 1 Justification
- 1.1 Peptone, extrait de levure et triptein
- 1.2 Motilité
- 1.3 Glucose
- 1,4 L-ornithine
- 1.5 indicateur de pH
- 2 Technique d'ensemencement et de développement
- 3 Préparation
- 3.1 Milieu MIO
- 3.2 Réactif Kovacs (révélateur de test indole)
- 4 Utilisation
- 5 Contrôle de la qualité
- 6 Références
Base
Peptone, extrait de levure et triptein
Ces éléments contribuent au pouvoir nutritionnel de ce milieu. Ils servent de source de nutriments et d'acides aminés essentiels pour le développement bactérien.
De plus, la triptein est une source de tryptophane pour démontrer la présence de l'enzyme tryptophanase, qui dégrade le tryptophane par désamination réductrice, libérant de l'indole, de l'acide pyruvique, de l'ammoniac et de l'énergie..
L'indole est incolore, donc sa présence est révélée en ajoutant cinq gouttes de réactif d'Ehrlich ou de Kovacs, tous deux contenant du p-diméthylaminobenzaldéhyde..
Le groupe aldéhyde de ce composé réagit avec l'indole, générant un produit rouge fuchsia en forme d'anneau à la surface de la gélose..
Toute trace de couleur doit être considérée comme un test positif. La preuve doit être lue immédiatement, car avec le temps la couleur se dégrade.
De plus, ce test doit être révélé après que les résultats de motilité et de décarboxylation de l'ornithine aient été notés..
Interprétation
Test positif: formation d'un anneau rouge fuchsia lors de l'ajout de gouttes de réactif de Kovacs.
Test négatif: pas de formation d'anneau.
La motilité
La capacité des bactéries à se déplacer sera mise en évidence si un milieu trouble est observé ou s'il y a une ligne de croissance épaisse s'étendant autour de l'inoculation initiale..
Un test de motilité négatif sera mis en évidence en observant une fine ligne de croissance, et tout ce qui l'entoure sera sans croissance..
Il est important que la motilité soit lue avant que l'indole ne soit révélée, car l'ajout du réactif obscurcit tout le milieu..
Chez les bactéries mobiles mais à croissance lente, il est difficile de démontrer leur motilité avec ce milieu. Dans ce cas, il est recommandé d'utiliser d'autres tests ou méthodes, tels que la motilité moyenne ou la méthode drop-pending..
Glucose
Le glucose est le glucide fermentescible qui, en plus de fournir de l'énergie, acidifie l'environnement, condition nécessaire à la décarboxylation de l'acide aminé ornithine..
La fermentation du glucose doit toujours avoir lieu, en partant du principe que toutes les bactéries appartenant à la famille des Enterobacteriaceae fermentent le glucose..
L-ornithine
Dans le cas où les bactéries produisent l'enzyme ornithine décarboxylase, celle-ci peut agir une fois que le milieu a été acidifié par la fermentation du glucose..
L'enzyme ornithine décarboxylase agit sur le groupe carboxyle de l'acide aminé en produisant une amine appelée putresine qui alcalinise à nouveau le milieu.
Ce test doit être lu après 24 heures d'incubation, car si vous essayez de lire avant, vous pouvez mal interpréter le test avec un faux négatif.
Il faut se rappeler que la première réaction qui se produit est la fermentation du glucose, c'est pourquoi le milieu jaunit dans une phase initiale (10 à 12 premières heures). Si la décarboxylation de l'ornithine se produit par la suite, le milieu deviendra violet.
Il est important d'interpréter le test de décarboxylation de l'ornithine avant de révéler l'indole, car l'ajout du réactif de Kovacs modifie la couleur du milieu..
Interprétation
Test négatif: fond jaune moyen ou jaune.
Test positif: à moitié complètement violet.
Indicateur de pH
Dans ce cas, le violet de bromocrésol est utilisé; celui en charge de révéler quand il y a un changement de pH dans le milieu. Lorsqu'il est acidifié, l'indicateur devient jaune et lorsqu'il est alcalinisé, il devient violet.
Technique d'ensemencement et de développement
Pour semer le milieu MIO, une boucle ou une aiguille droite est utilisée et avec elle une partie de la colonie à étudier est collectée..
Une ponction profonde est pratiquée au milieu du MIO en ligne droite. Il n'est pas conseillé d'effectuer une double ponction, car elle peut donner une fausse image de motilité si les crevaisons ne sont pas effectuées au même endroit.
Incuber pendant 24 à 48 heures à 37 ° C en aérobiose. Observer les résultats dans cet ordre: motilité, décarboxylation de l'ornithine et enfin révéler l'indole.
Il est conseillé d'enlever aseptiquement 2 ml de milieu, de le transférer dans un tube stérile et d'y effectuer le test d'indole, de sorte que s'il est négatif, le reste du tube d'origine puisse être incubé pendant 24 heures supplémentaires, pour révéler le indole à nouveau..
Le développement de l'indole s'effectue de la manière suivante: 3 à 5 gouttes de réactif de Kovacs sont ajoutées au milieu MIO et celui-ci est agité vigoureusement. On observe si un anneau rouge fuchsia apparaît ou non.
préparation
MIO moyen
Peser 31 g de milieu MIO et dissoudre dans un litre d'eau distillée..
Chauffer jusqu'à ébullition pendant une minute, en secouant fréquemment jusqu'à ce que la gélose soit complètement dissoute. Répartir 4 ml de milieu dans des tubes à essai 13/100 avec des bouchons en coton.
Stériliser en autoclave à 121 ° C pendant 15 minutes. Retirer de l'autoclave et laisser reposer droit dans un support, de manière à former un bloc semi-solide.
A conserver au réfrigérateur entre 2 et 8 ° C. Laisser réchauffer avant de semer la souche bactérienne.
La couleur du milieu déshydraté est beige et celle du milieu préparé légèrement violet opalescent..
Le pH final du milieu préparé est de 6,5 ± 0,2
Le milieu devient jaune à pH acide et violet à pH alcalin.
Réactif Kovacs (révélateur de test indole)
Ce réactif est préparé comme suit:
150 ml d'alcool amylique, isoamylique ou butylique (l'un des trois) sont mesurés. On y dissout 10 g de p-diméthylaminobenzaldéhyde. Ensuite, 50 ml d'acide chlorhydrique concentré sont ajoutés lentement..
Le réactif préparé est incolore ou jaune clair. Il doit être conservé dans une bouteille ambrée et conservé au réfrigérateur. Une couleur marron foncé montre sa détérioration.
Le réactif Kovacs peut également être remplacé par le réactif Ehrlich. Ce dernier, étant plus sensible, est préféré pour révéler l'indole dans les bactéries qui le produisent en quantités infimes, comme dans certains bâtonnets Gram négatifs non fermentants et certains anaérobies..
Utiliser
Ce milieu est un test qui complète une batterie de tests biochimiques pour l'identification des bactéries appartenant à la famille des Enterobacteriaceae..
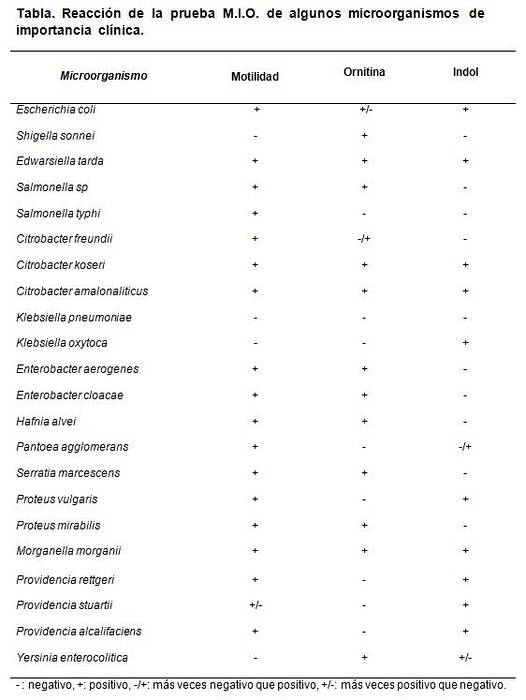
Les données de la décarboxylation de l'ornithine servent à différencier Shigella sonnei, qui donne du positif, de Shigella boydii, Shigella flexneri et S. dysenterieae, qui donnent des négatifs.
Il différencie également le genre Klebsiella, qui teste négatif, du genre Enterobacter, où la plupart de ses espèces sont testées positives..
Contrôle de qualité
Chaque fois qu'un lot de milieu MIO est préparé, un test de contrôle peut être effectué. Pour cela, des souches connues ou certifiées sont utilisées pour observer le comportement du milieu..
Les souches utilisables sont Escherichia coli, Morganella morganii, Klebsiella pneumoniae, Enterobacter aerogenes Oui Proteus mirabilis.
Les résultats attendus sont E. coli et M. morganii. Dan M: +, I: + et O: +.
Klebsiella pneumoniae donne tout négatif (M: -, I: -, O :-). Proteus mirabilis Oui Enterobacter aerogenes donner M: + I: - et O: +.
Les références
- Mac Faddin J. (2003). Tests biochimiques pour l'identification des bactéries d'importance clinique. 3e éd. Éditorial Panamericana. Buenos Aires. Argentine.
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnostic microbiologique Bailey & Scott. 12 éd. Éditorial Panamericana S.A. Argentine.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnostic microbiologique. 5e éd. Éditorial Panamericana S.A. Argentine.
- Laboratoires Britannia. MIO Medio 2015. Disponible sur: britanialab.com
- Laboratoires BD. BBL Motility Indole Ornithine (MIO) Medium. 2007. Disponible sur: bd.com
- Laboratoires Valtek. Moyenne M.I.O. Motilité, indole, ornithine. 2010. Disponible sur: andinamedica.com



Personne n'a encore commenté ce post.