
Structure des molécules amphipathiques, caractéristiques, exemples
le molécules amphipathiques ou amphiphiles Ce sont ceux qui peuvent ressentir à la fois affinité ou répulsion pour un certain solvant. Les solvants sont chimiquement classés comme polaires ou apolaires; hydrophile ou hydrophobe. Ainsi, ces types de molécules peuvent «aimer» l'eau, tout comme ils peuvent aussi la «détester»..
Selon la définition précédente, il n'y a qu'une seule façon pour que cela soit possible: ces molécules doivent avoir des régions polaires et apolaires dans leurs structures; Soit ils sont distribués plus ou moins de manière homogène (comme c'est le cas avec les protéines par exemple), soit ils sont localisés de manière hétérogène (dans le cas des tensioactifs)

Les tensioactifs, également appelés détergents, sont peut-être les molécules amphipathiques les plus connues de toutes depuis des temps immémoriaux. Depuis que l'homme a été captivé par l'étrange physionomie d'une bulle, préoccupé par la préparation de savons et de produits d'entretien, il a rencontré maintes et maintes fois le phénomène de tension superficielle..
Observer une bulle revient à assister à un «piège» dont les parois, formées par l'alignement de molécules amphipathiques, retiennent le contenu gazeux de l'air. Ses formes sphériques sont les plus stables mathématiquement et géométriquement, car elles réduisent au minimum la tension superficielle de l'interface air-eau..
Cela dit, deux autres caractéristiques des molécules amphipathiques ont été discutées: elles ont tendance à s'associer ou à s'auto-assembler, et certaines tensions de surface plus faibles dans les liquides (ceux qui peuvent le faire sont appelés surfactants).
Du fait de la forte tendance à s'associer, ces molécules ouvrent un champ d'étude morphologique (voire architecturale) de leurs nanoagrégats et des supramolécules qui les composent; dans le but de concevoir des composés fonctionnalisables et interagissant de manière incommensurable avec les cellules et leurs matrices biochimiques.
Index des articles
- 1 Structure
- 1.1 Interactions intermoléculaires
- 1.2 Divers
- 2 Caractéristiques des molécules amphipathiques
- 2.1 Association
- 2.2 Physique
- 3 exemples
- 4 applications
- 4.1 Membranes cellulaires
- 4.2 Dispersants
- 4.3 Émulsifiants
- 4.4 Détergents
- 4.5 Antioxydants
- 5 Références
Structure
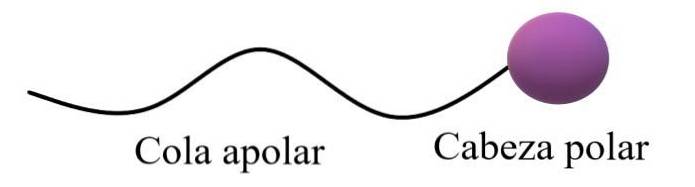
On a dit que les molécules amphiphiles ou amphipathiques avaient une région polaire et une région apolaire. La région apolaire consiste généralement en une chaîne carbonée saturée ou insaturée (avec des liaisons doubles ou triples), qui est représentée par une "queue apolaire"; accompagné d'une «tête polaire», dans laquelle résident les atomes les plus électronégatifs.
La structure générale supérieure illustre les commentaires du paragraphe précédent. La tête polaire (sphère violette) peut être des groupes fonctionnels ou des cycles aromatiques qui ont des moments dipolaires permanents et sont également capables de former des liaisons hydrogène. Par conséquent, la teneur en oxygène et en azote la plus élevée doit y être.
Dans cette tête polaire, il peut également y avoir des charges ioniques, négatives ou positives (ou les deux à la fois). Cette région est celle qui montre une forte affinité pour l'eau et les autres solvants polaires..
D'autre part, la queue apolaire, étant donné ses liaisons C-H prédominantes, interagit à travers les forces de diffusion de Londres. Cette région est responsable du fait que les molécules amphipathiques présentent également une affinité pour les graisses et les molécules apolaires dans l'air (Ndeux, COdeux, Ar, etc.).
Dans certains textes de chimie, le modèle de la structure supérieure est comparé à la forme d'une sucette.
Interactions intermoléculaires
Lorsqu'une molécule amphipathique entre en contact avec un solvant polaire, par exemple de l'eau, ses régions exercent des effets différents sur les molécules du solvant..
Pour commencer, les molécules d'eau cherchent à solvater ou hydrater la tête polaire, en restant à l'écart de la queue apolaire. Dans ce processus, un désordre moléculaire est créé.
Pendant ce temps, les molécules d'eau autour de la queue apolaire ont tendance à s'organiser comme s'il s'agissait de petits cristaux, leur permettant ainsi de minimiser les répulsions. Dans ce processus, un ordre moléculaire est créé.
Entre troubles et ordres, viendra un moment où la molécule amphipathique cherchera à interagir avec une autre, ce qui se traduira par un processus beaucoup plus stable..
Miscelas
Les deux seront approchés par leurs queues apolaires ou leurs têtes polaires, de telle sorte que les régions liées interagissent en premier. C'est la même chose que d'imaginer que deux "sucettes violettes" de l'image ci-dessus, s'approchent en entrelaçant leurs queues noires, ou en joignant leurs deux têtes violettes..
Et commence ainsi un phénomène d'association intéressant, dans lequel plusieurs de ces molécules se rejoignent consécutivement. Ils ne sont pas associés arbitrairement, mais selon une série de paramètres structuraux, qui finissent par isoler les queues apolaires dans une sorte de «noyau apolaire», tout en exposant les têtes polaires comme une coquille polaire..
On dit alors qu'un miscella sphérique est né. Cependant, lors de la formation du miscela, il y a une étape préliminaire consistant en ce que l'on appelle une bicouche lipidique. Ceux-ci et d'autres sont quelques-unes des nombreuses macrostructures que les molécules amphiphiles peuvent adopter.
Caractéristiques des molécules amphipathiques
Association

Si les queues apolaires sont considérées comme des unités noires et les têtes polaires comme des unités violettes, on comprendra pourquoi dans l'image supérieure l'écorce du miscela est violette et son noyau est noir. Le noyau est apolaire et ses interactions avec les molécules d'eau ou de solvant sont nulles..
Si, au contraire, le solvant ou milieu est apolaire, ce sont les têtes polaires qui subiront les répulsions, et par conséquent elles seront situées au centre du miscella; c'est-à-dire qu'il est inversé (A, image du bas).
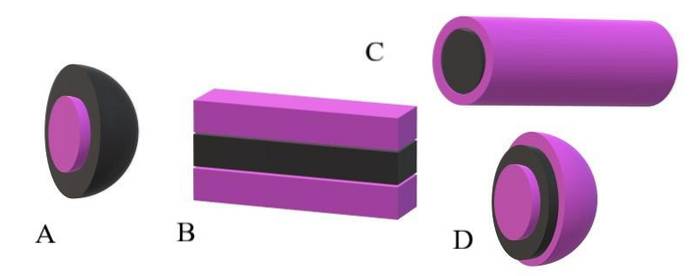
On observe que le miscela inversé a une coquille apolaire noire et un noyau polaire violet. Mais, avant la formation des miscelas, on trouve les molécules amphiphiles modifiant individuellement l'ordre des molécules de solvant. Concentration accrue, ils commencent à s'associer dans une structure d'une ou deux couches (B).
À partir de B, les lames commencent à se courber pour former D, une vésicule. Une autre possibilité, selon la forme de la queue apolaire par rapport à sa tête polaire, est qu'ils s'associent pour donner naissance à un miscella cylindrique (C).
Nanoagrégats et supramolécules
Il existe donc cinq structures principales, qui révèlent une caractéristique fondamentale de ces molécules: leur forte tendance à s'associer et à s'auto-assembler en supramolécules, qui s'agrègent pour former des nanoagrégats..
Ainsi, les molécules amphiphiles ne se trouvent pas seules mais en association..
Physique
Les molécules amphipathiques peuvent être neutres ou chargées ioniquement. Ceux qui ont des charges négatives ont un atome d'oxygène avec une charge formelle négative dans leur tête polaire. Certains de ces atomes d'oxygène proviennent de groupes fonctionnels tels que: -COO-, -SW4-, -SW3- ou -PO4-.
Concernant les charges positives, elles proviennent généralement d'amines, RNH3+.
La présence ou l'absence de ces charges ne change rien au fait que ces molécules forment généralement des solides cristallins; ou, s'ils sont relativement légers, ils se retrouvent sous forme d'huiles.
Exemples
Quelques exemples de molécules amphipathiques ou amphiphiles seront mentionnés ci-dessous:
-Phofolipides: phosphatidyléthanolamine, sphingomyéline, phosphatidylsérine, phosphatidylcholine.
-Cholestérol.
-Les glycolipides.
-Laurylsulfate de sodium.
-Protéines (ce sont des amphiphiles, mais pas des tensioactifs).
-Graisses phénoliques: cardanol, cardoles et acides anacardiques.
-Bromure de cétyltriméthylammonium.
-Acides gras: palmitique, linoléique, oléique, laurique, stéarique.
-Alcools à longue chaîne: 1-dodécanol et autres.
-Polymères amphiphiles: tels que les résines phénoliques éthoxylées.
Applications
Membranes cellulaires
L'une des conséquences les plus importantes de la capacité de ces molécules à s'associer est qu'elles construisent une sorte de paroi: la bicouche lipidique (B).
Cette bicouche s'étend pour protéger et réguler l'entrée et la sortie des composés dans les cellules. Il est dynamique, car ses queues apolaires tournent aidant les molécules amphipathiques à se déplacer..
De même, lorsque cette membrane est fixée à deux extrémités, pour l'avoir verticalement, elle sert à mesurer sa perméabilité; et avec cela, des données précieuses sont obtenues pour la conception de matériaux biologiques et de membranes synthétiques à partir de la synthèse de nouvelles molécules amphipathiques avec différents paramètres structuraux..
Dispersants
Dans l'industrie pétrolière, ces molécules, et les polymères synthétisés à partir d'elles, sont utilisées pour disperser les asphaltènes. L'objectif de cette application repose sur l'hypothèse que les asphaltènes sont constitués d'un solide colloïdal, avec une forte tendance à floculer et à sédimenter sous forme d'un solide brun-noir qui pose de graves problèmes économiques..
Les molécules amphipathiques aident à maintenir les asphaltènes dispersés plus longtemps face aux changements physico-chimiques du brut..
Émulsifiants
Ces molécules aident à mélanger deux liquides qui ne seraient pas miscibles dans des conditions ordinaires. Dans les crèmes glacées, par exemple, ils aident l'eau et l'air à faire partie du même solide avec la graisse. Parmi les émulsifiants les plus utilisés à cet effet figurent ceux dérivés d'acides gras comestibles.
Détergents
Le caractère amphiphile de ces molécules est utilisé pour piéger les graisses ou les impuretés apolaires, pour être ensuite emportées en même temps par un solvant polaire, tel que l'eau..
Comme l'exemple des bulles où l'air était emprisonné, les détergents emprisonnent la graisse dans leurs micelles, qui, ayant une coquille polaire, interagissent efficacement avec l'eau pour éliminer la saleté..
Antioxydants
Les têtes polaires sont d'une importance vitale car elles définissent les multiples utilisations que ces molécules peuvent avoir dans le corps.
S'ils ont, par exemple, un ensemble de cycles aromatiques (y compris des dérivés d'un cycle phénolique) et de cycles polaires capables de neutraliser les radicaux libres, alors il y aura des antioxydants amphiphiles; et s'ils manquent également d'effets toxiques, de nouveaux antioxydants seront disponibles sur le marché.
Les références
- Alberts B, Johnson A, Lewis J et al. (2002). Biologie moléculaire de la cellule. 4e édition. New York: Garland Science; La bicouche lipidique. Récupéré de: ncbi.nlm.nih.gov
- Jianhua Zhang. (2014). Molécules amphiphiles. Springer-Verlag Berlin Heidelberg, E. Droli, L. Giorno (éd.), Encyclopedia of Membranes, DOI 10.1007 / 978-3-642-40872-4_1789-1.
- Dit Joseph. (2019). Définition des molécules amphipathiques. Étude. Récupéré de: study.com
- Lehninger, A. L. (1975). Biochimie. (2e édition). Worth Publishers, inc.
- Mathews, C. K., van Holde, K. E. et Ahern, K. G. (2002). Biochimie. (3e édition). Pearson Addison Weshley.
- Helmenstine, Anne Marie, Ph.D. (31 mars 2019). Qu'est-ce qu'un surfactant? Récupéré de: thinkco.com
- Domenico Lombardo, Mikhail A. Kiselev, Salvatore Magazù et Pietro Calandra (2015). Auto-assemblage des amphiphiles: concepts de base et perspectives futures des approches supramoléculaires. Advances in Condensed Matter Physics, vol. 2015, Article ID 151683, 22 pages, 2015. doi.org/10.1155/2015/151683.
- Anankanbil S., Pérez B., Fernandes I., Magdalena K. Widzisz, Wang Z., Mateus N. et Guo Z. (2018). Un nouveau groupe de molécules amphiphiles synthétiques phénoliques pour des applications polyvalentes: caractérisation physico-chimique et étude de toxicité cellulaire. Scientific Reportsvolume 8, Numéro d'article: 832.



Personne n'a encore commenté ce post.