
Moment dipolaire comment il est calculé et exemples
le moment dipolaire est une propriété chimique qui indique la répartition hétérogène des charges électriques dans une molécule. Il est exprimé en unités Debye, 3,33 · 10-30 C · m, et généralement ses valeurs vont de 0 à 11 D.
Les composés hautement polaires ont tendance à avoir de grands moments dipolaires; tandis que les apolaires, petits moments dipolaires. Plus les charges électriques sont polarisées dans une molécule, plus son moment dipolaire est important; c'est-à-dire qu'il doit y avoir une région riche en électrons, δ-, et une autre pauvre en électrons, δ+.

Le moment dipolaire, μ, est une grandeur vectorielle, il est donc affecté par les angles des liaisons et, en général, par la structure moléculaire.
Lorsque la molécule est linéaire, elle peut être comparée à une gomme bicolore. Son extrémité négative δ-, correspondrait à la couleur rouge; tandis que le positif, δ +, serait la couleur bleue. Au fur et à mesure que la magnitude des charges négatives au pôle δ- augmente et que la distance qui la sépare de δ +, le moment dipolaire augmente.
Chimiquement, cela signifie que plus la différence d'électronégativité entre deux atomes est grande, et plus la distance qui les sépare est longue, plus le moment dipolaire entre eux est important..
Index des articles
- 1 Comment le moment dipolaire est-il calculé?
- 2 exemples
- 2.1 Eau
- 2.2 Méthanol
- 2.3 Ammoniac
- 2.4 Éthanol
- 2.5 Dioxyde de carbone
- 2.6 Méthane
- 3 Références
Comment calculez-vous le moment dipolaire?
Il est considéré comme une liaison covalente entre deux atomes, A et B:
UN B
La distance entre les charges partielles positives et négatives est déjà définie par la longueur de leur liaison:
Àδ+-Bδ-
Parce que les protons et les électrons ont la même magnitude de charge électrique mais avec des signes opposés, 1,6 · 10-19C, c'est celui qui est pris en compte lors de l'évaluation du moment dipolaire entre A et B à l'aide de l'équation suivante:
μ = δré
Où μ est le moment dipolaire, δ est la charge de l'électron sans signe négatif, et ré la longueur du lien exprimée en mètres. Par exemple, en supposant que ré a une valeur de 2 Å (1 10-dixm) le moment dipolaire, μA-B sera:
μA-B = (1,6 10-19C) · (2 · 10-dixm)
= 3,210-29Cm
Mais comme cette valeur est très petite, l'unité Debye est utilisée:
μ = (3 210-29C · m) · (1 D / 3,33 · 10-30 Cm)
= 9,60 D
Cette valeur de μA-B pourrait laisser supposer que la liaison A-B est plus ionique que covalente.
Exemples
L'eau
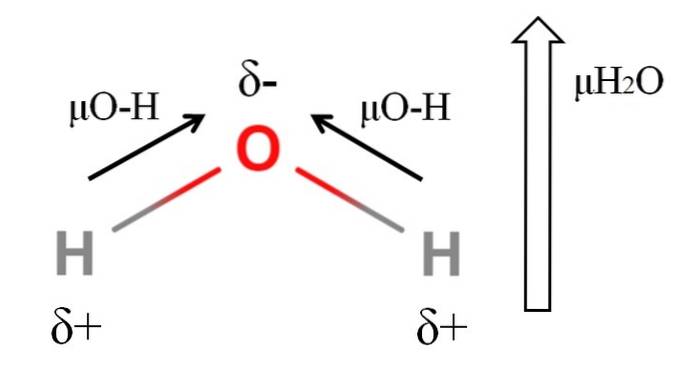
Pour calculer le moment dipolaire d'une molécule, tous les moments dipolaires de leurs liaisons respectives doivent être additionnés de manière vectorielle, en considérant les angles de liaison et un peu de trigonométrie. Ceci au début.
L'eau possède l'un des moments dipolaires les plus importants auxquels on pourrait s'attendre pour un composé covalent. Dans l'image du haut, nous avons que les atomes d'hydrogène ont des charges partielles positives, δ +, tandis que l'oxygène porte une charge partielle négative, δ-. La liaison O-H est assez polaire (1,5D), et il y en a deux dans une molécule HdeuxOU ALORS.
Habituellement, un vecteur est dessiné qui est dirigé de l'atome le moins électronégatif (H) vers l'atome le plus électronégatif (O). Bien qu'ils ne soient pas dessinés, sur l'atome d'oxygène, il y a deux paires d'électrons non partagés, qui «concentrent» davantage la région négative..
En raison de la géométrie angulaire du HdeuxOu, les moments dipolaires s'ajoutent dans la direction de l'atome d'oxygène. Notez que la somme des deux μO-H donnerait 3D (1,5 + 1,5); mais ce n'est pas comme ça. Le moment dipolaire de l'eau a une valeur expérimentale de 1,85D. L'effet de l'angle proche de 105 ° entre les liaisons H-O-H est montré ici..
Méthanol
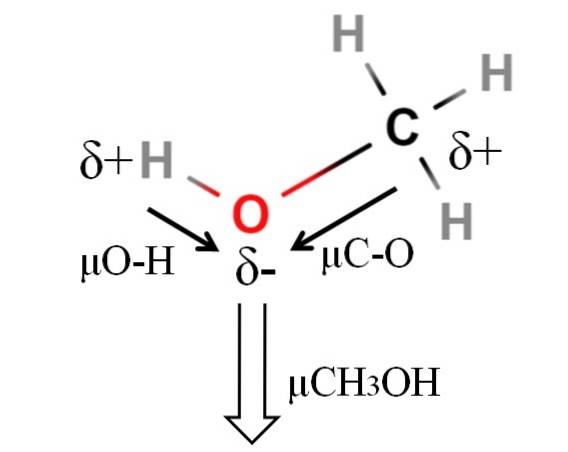
Le moment dipolaire du méthanol est de 1,69D. C'est moins que celui de l'eau. Par conséquent, les masses atomiques n'ont pas beaucoup d'influence sur le moment dipolaire; mais leurs rayons atomiques le sont. Dans le cas du méthanol, on ne peut pas affirmer que sa liaison H-O a un µ égal à 1,5D; puisque, les environnements moléculaires sont différents en CH3OH et HdeuxOU ALORS.
C'est pourquoi il faudrait mesurer la longueur de la liaison H-O dans le méthanol pour calculer μO-H. Ce que l'on peut dire, c'est que μO-H est plus grand que μC-O, car la différence d'électronégativité entre le carbone et l'oxygène est inférieure à celle entre l'hydrogène et l'oxygène..
Le méthanol est l'un des solvants les plus polaires que l'on puisse trouver avec l'eau et l'ammoniac..
Ammoniac
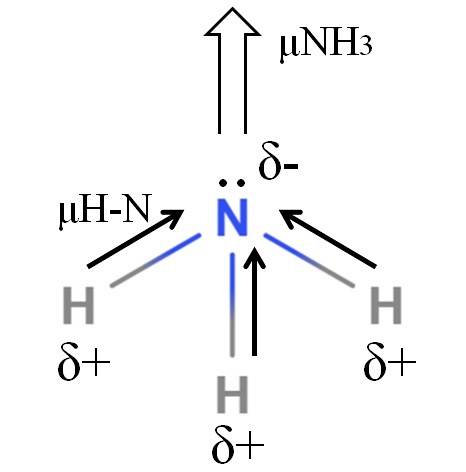
Les liaisons H-N sont assez polaires, donc l'azote, en raison de son électronégativité plus élevée, attire les électrons vers lui (image du haut). En plus de cela, nous avons une paire d'électrons non partagés, qui contribuent leurs charges négatives à la région δ-. Par conséquent, les charges électriques prédominent sur l'atome d'azote de l'ammoniac..
L'ammoniac a un moment dipolaire de 1,42D, inférieur à celui du méthanol. Si l'ammoniac et le méthanol pouvaient être transformés en courants d'air, on verrait que le tirage de méthanol a des pôles plus définis que le tirage d'ammoniac..
Éthanol
Dans le cas de l'éthanol, CH3CHdeuxOH, son moment dipolaire est très proche de celui du méthanol, mais il a tendance à avoir des valeurs plus faibles. Comme il y a plus d'atomes de carbone composant la région δ +, l'atome d'oxygène représentant δ- commence à perdre un peu de son "intensité négative relative".
Dioxyde de carbone
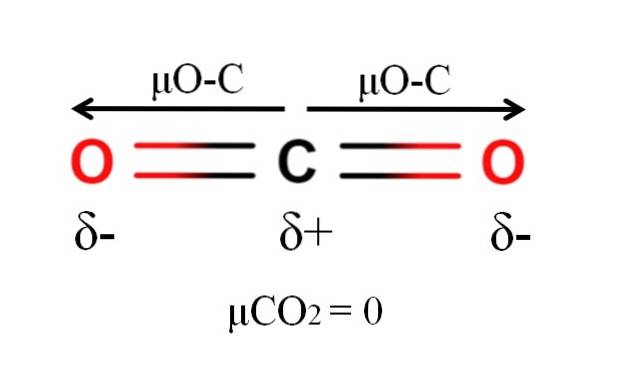
Le dioxyde de carbone a deux liaisons polaires, C = O, avec leurs moments dipolaires respectifs μO-C. Cependant, comme on peut le voir sur l'image ci-dessus, la géométrie linéaire du COdeux provoque l'annulation vectorielle des deux μO-C, même lorsque le carbone a une charge partielle positive et les oxygènes ont des charges partielles négatives.
Pour cette raison, le dioxyde de carbone est une molécule apolaire, car μCOdeux a une valeur de 0D.
Méthane
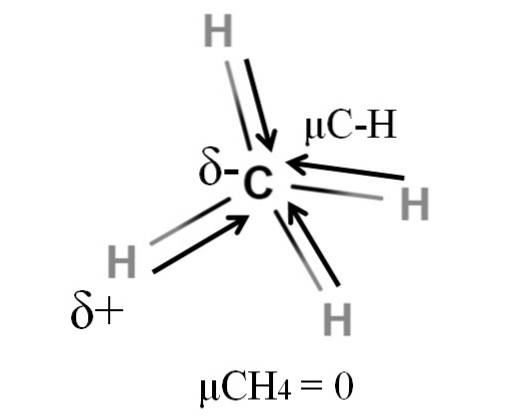
Le méthane et le dioxyde de carbone ont tous deux un point commun: ce sont des molécules hautement symétriques. En général, plus une molécule est symétrique, plus son moment dipolaire est petit..
Si nous voyons la molécule CH4, ses liaisons C-H sont polaires et les électrons sont dirigés vers l'atome de carbone car il est légèrement plus électronégatif. On pourrait penser que le carbone devrait être une région δ- hautement négative; comme une gomme avec son centre rouge profond et ses extrémités bleuâtres.
Cependant, en divisant le CH4 en deux, nous obtiendrions deux moitiés H-C-H, une à gauche et l'autre à droite, semblable à la molécule HdeuxO. Ainsi, le moment dipolaire résultant de l'addition de ces deux μC-H s'annulerait avec celui de l'autre moitié. Et donc, μCH4 a une valeur de 0D.
Les références
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE.
- Walter J. Moore. (1963). Chimie physique. En cinétique chimique. Quatrième édition, Longmans.
- Ira N. Levine. (2009). Principes de physicochimie. Sixième édition, pp. 479-540. Mc Graw Hill.
- Helmenstine, Anne Marie, Ph.D. (29 janvier 2020). Définition du moment dipolaire. Récupéré de: thinkco.com
- Blaber Mike. (29 septembre 2019). Moments dipolaires. Chimie LibreTexts. Récupéré de: chem.libretexts.org
- LaRita Williams. (2020). Moment dipolaire: définition, équation et exemples. Étude. Récupéré de: study.com
- Wikipédia. (2020). Moment dipolaire de liaison. Récupéré de: en.wikipedia.org


Personne n'a encore commenté ce post.