
Structure, propriétés, utilisations, risques du nitrate de sodium (NaNO3)

le nitrate de sodium est un solide inorganique cristallin formé par un ion sodium Na+ et un ion nitrate NO3-. Sa formule chimique est NaNO3. Dans la nature, il se trouve sous forme de minéral nitratine ou nitratite, que l'on trouve en abondance dans le désert d'Atacama au Chili, c'est pourquoi ce minéral est également appelé salpêtre chilien ou caliche.
Le nitrate de sodium est un solide non combustible, mais il peut accélérer l'oxydation ou la combustion de matières inflammables. Pour cette raison, il est largement utilisé dans les feux d'artifice, les explosifs, les allumettes, les briques de charbon et certains types de pesticides, pour tuer les rongeurs et autres petits mammifères..

La capacité de favoriser la combustion ou l'inflammation d'autres matériaux signifie qu'il doit être manipulé avec une grande prudence. S'il est exposé aux flammes ou au feu, il peut exploser. Malgré cela, le NaNO3 Il est utilisé dans l'industrie alimentaire car il possède des propriétés conservatrices, notamment pour les viandes et certains types de fromages..
Cependant, son ingestion en excès peut entraîner des problèmes de santé, notamment chez les femmes enceintes, les bébés et les enfants. En se transformant en nitrites dans le système digestif, il peut provoquer certaines maladies.
Index des articles
- 1 Structure chimique
- 2 Nomenclature
- 3 propriétés
- 3.1 État physique
- 3.2 Poids moléculaire
- 3.3 Point de fusion
- 3.4 Point d'ébullition
- 3.5 Densité
- 3.6 Solubilité
- PH 3,7
- 3.8 Autres propriétés
- 4 Obtention
- 4.1 Présence dans le corps humain
- 5 utilisations
- 5.1 Dans l'industrie alimentaire
- 5.2 Dans les engrais
- 5.3 En tant que promoteur ou facilitateur de la combustion ou de l'explosion
- 5.4 Éliminer les rongeurs et autres mammifères
- 5.5 Lors de la préparation d'autres composés
- 5.6 Dans l'extraction de métaux à partir de déchets électroniques
- 5.7 Dans la recherche sur la santé et l'exercice
- 5.8 Dans diverses utilisations
- 6 risques
- 6.1 Dangers de la manipulation
- 6.2 Problèmes liés à son ingestion avec de la nourriture ou de l'eau
- 7 Nitrate de sodium dans les aliments
- 8 Références
Structure chimique
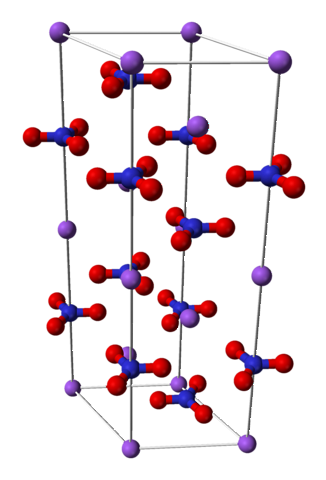
Le nitrate de sodium est composé d'un cation sodium Na+ et un anion nitrate NO3-.
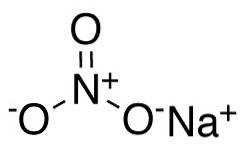
Dans l'anion nitrate NO3- l'azote N a une valence de +5 et l'oxygène une valence de -2. Pour cette raison, l'anion nitrate a une charge négative..
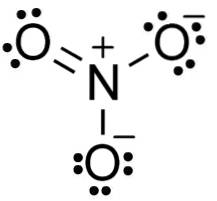
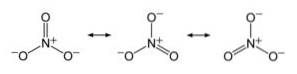
Anion NON3- il a une structure plate et symétrique, dans laquelle les trois oxygènes distribuent la charge négative de manière égale ou uniforme.
Nomenclature
-Nitrate de sodium
-Nitrate de sodium
-Salpêtre de sodium (de l'anglais salpêtre de sodium)
-Nitro soda (de l'anglais soda nitre)
-Salpêtre du Chili
-Nitrate du Chili
-Nitratine
-Nitratite
-Caliche
Propriétés

État physique
Cristaux solides, trigonaux ou rhomboédriques incolores à blancs.
Poids moléculaire
84,995 g / mol
Point de fusion
308 ºC
Point d'ébullition
380 ºC (se décompose).
Densité
2 257 g / cm3 à 20 ºC.
Solubilité
Soluble dans l'eau: 91,2 g / 100 g d'eau à 25 ºC ou 1 g dans 1,1 mL d'eau. Légèrement soluble dans l'éthanol et le méthanol.
pH
Les solutions de nitrate de sodium sont neutres, c'est-à-dire ni acides ni basiques, leur pH est donc de 7.
Autres propriétés
C'est un solide hygroscopique, c'est-à-dire qu'il absorbe l'eau de l'environnement.

Sa dissolution dans l'eau refroidit la solution, on dit donc que ce processus de dissolution est endothermique, c'est-à-dire que lorsqu'il se dissout, il absorbe la chaleur de l'environnement et c'est pourquoi la solution se refroidit..
À très basse température, le nitrate de sodium est soluble dans l'ammoniac liquide NH3, formant NaNO34NH3 en dessous de -42 ºC.
Nano3 Il n'est pas combustible, mais sa présence accélère la combustion des matériaux ou des composés qui le sont. En effet, lorsqu'il est chauffé, il produit de l'oxygène Odeux, entre autres gaz.
Obtention
Il est obtenu principalement par extraction de gisements minéraux ou de salpêtre au Chili (caliche ou nitratite). Pour cela, de la saumure est utilisée puis une cristallisation et une recristallisation sont effectuées pour obtenir des cristaux de NaNO.3 plus pur.
Ces mines se trouvent principalement en Amérique du Sud dans le nord du Chili dans le désert d'Atacama. Là, il est associé au nitrate de potassium KNO3 et la décomposition de la matière organique.
Il peut également être obtenu en faisant réagir de l'acide nitrique avec du carbonate de sodium NadeuxCO3 ou avec de l'hydroxyde de sodium NaOH:
2 HNO3 + N / AdeuxCO3 → 2 NaNO3 + COdeux↑ + HdeuxOU ALORS
Présence dans l'organisme humain
Le nitrate de sodium peut pénétrer dans le corps humain par la nourriture et l'eau potable qui en contient..
60 à 80% des nitrates ingérés proviennent de fruits et légumes. Une deuxième source est la charcuterie. Il est utilisé par l'industrie de la viande pour empêcher la croissance des microbes et pour conserver la couleur.
Cependant, une forte proportion de nitrate présente dans le corps humain provient de sa synthèse endogène ou de processus à l'intérieur du corps..
Applications
Dans l'industrie alimentaire
Il est utilisé comme conservateur dans les aliments, comme agent de salaison pour les viandes marinées et comme agent de rétention de la couleur pour les viandes. Les aliments qui peuvent en contenir sont le bacon, les saucisses, le jambon et certains fromages.

Dans les engrais
Le nitrate de sodium est utilisé dans les mélanges d'engrais, pour fertiliser les cultures de tabac, de coton et de légumes.

En tant que promoteur ou promoteur de la combustion ou de l'explosion
Nano3 il est utilisé comme oxydant dans de nombreuses applications. C'est un solide riche en oxygène qui facilite le processus d'allumage en produisant de l'Odeux.
La présence de NaNO3 fait que les matériaux ne nécessitent pas d'oxygène provenant de sources externes pour s'enflammer car ils fournissent suffisamment d'Odeux quant aux réactions exothermiques auto-entretenues (génératrices de chaleur) qui se produisent pendant l'allumage ou l'explosion.
Il a longtemps été utilisé comme oxydant principal dans les matériaux pyrotechniques (feux d'artifice), comme composant oxydant dans les explosifs et les agents de détonation ou de dynamitage, et comme propulseur..

Il est également utilisé pour améliorer la combustion des briques de charbon de bois (briquettes), pour favoriser l'éclairage dans les allumettes et même pour améliorer les propriétés combustibles du tabac..
Pour éliminer les rongeurs et autres mammifères
Il est utilisé pour un type spécial de pesticide. Les compositions qui le contiennent sont des fumigants pyrotechniques qui sont placés et incendiés dans des terriers, libérant des doses mortelles de gaz toxiques.
Pour cette raison, il est utilisé pour lutter contre divers rongeurs, marmottes, coyotes et mouffettes, dans les champs ouverts, les prairies, les zones non cultivées, les pelouses et les terrains de golf..
Dans la préparation d'autres composés
Utilisé dans la fabrication d'acide nitrique HNO3, nitrite de sodium NaNOdeux, et agit également comme catalyseur dans la préparation de l'acide sulfurique HdeuxSW4.
Il est utilisé dans la fabrication de protoxyde d'azote NdeuxOu et comme agent oxydant dans la fabrication de composés pharmaceutiques.
Dans l'extraction de métaux à partir de déchets électroniques
Certains chercheurs ont découvert que NaNO3 facilite l'extraction non polluante des métaux contenus dans les déchets d'équipements électroniques (téléphones portables, tablettes, ordinateurs, etc.).
Les métaux utiles pouvant être extraits des composants de ces équipements électroniques sont le Nickel Ni, le Cobalt Co, le Manganèse Mn, le Zinc Zn, le Cuivre Cu et l'Aluminium Al.
L'extraction est réalisée en utilisant uniquement une solution de NaNO3 et un polymère. Et un rendement de 60% est atteint.
De cette manière, les déchets électroniques peuvent être recyclés, contribuant à la minimisation des déchets et à la récupération stable des ressources..
En recherche sur la santé et l'exercice
Selon certaines études, l'ingestion de suppléments de NaNO3 ou les aliments qui en contiennent ont naturellement des effets positifs sur la santé. Certains des aliments riches en nitrates sont les betteraves, les épinards et la roquette.
Les effets comprennent l'amélioration du système cardiovasculaire, l'abaissement de la tension artérielle, l'amélioration de la circulation sanguine et l'augmentation de la quantité d'oxygène dans les tissus qui font de l'exercice physique..
Cela indique que l'utilisation de NaNO pourrait être envisagée.3 comme médicament à faible coût dans la prévention et le traitement des patients souffrant de problèmes de tension artérielle.
De plus, il peut servir d'aide efficace et naturelle pour augmenter la puissance musculaire des athlètes.
Dans diverses utilisations

Il est utilisé comme oxydant et fondant dans la fabrication des émaux de verre et de céramique. Il est également utilisé dans les ciments spéciaux.
Sert d'agent chimique dans la récupération de l'étain de la ferraille, dans la coagulation du latex, dans l'industrie nucléaire et dans le contrôle de la corrosion dans les systèmes aqueux.
Des risques
Dangers de la manipulation
Il a la propriété d'accélérer la combustion des matières inflammables. Si vous êtes impliqué dans un incendie, une explosion peut se produire.
Lorsqu'il est exposé à la chaleur ou au feu pendant des périodes prolongées, il peut exploser, produisant des oxydes d'azote toxiques..
Problèmes liés à son ingestion avec de la nourriture ou de l'eau
Les nitrates lorsqu'ils sont ingérés peuvent devenir des nitrites à la fois dans la bouche et dans l'estomac et les intestins..
Les nitrites, lorsqu'ils réagissent avec les amines présentes dans certains aliments, peuvent devenir des nitrosamines dans un environnement acide comme dans l'estomac. Les nitrosamines sont cancérigènes.
Cependant, cela ne se produit pas lorsque les fruits et légumes contenant des nitrates sont consommés naturellement..
Selon certaines études, la présence de niveaux élevés de nitrate peut produire un trouble sanguin qui rend l'oxygène ne peut pas être libéré efficacement dans les tissus..
Cela peut se produire chez les bébés dont le lait maternisé est fabriqué à partir d'eau de puits contenant des nitrates..
Il a également été observé que des niveaux élevés de nitrate peuvent causer des problèmes dans la gestation des bébés, provoquant des avortements spontanés, des naissances prématurées ou des anomalies du tube neural du fœtus..
Récemment, il a été découvert que le nitrate de sodium peut présenter un risque pour le développement du système musculo-squelettique et que la communication nerf-muscle est affectée chez l'homme..
Nitrate de sodium dans les aliments

Le nitrate de sodium est synonyme de viandes, car avec le nitrite, ils y sont ajoutés afin de les préserver et d'améliorer leur apparence et leurs saveurs. Pour sa cause, la consommation excessive de viandes (hot dogs, bacon, jambons, poisson fumé, etc.) a été impliquée dans le lien inquiétant des cancers dans tout le système digestif.
Bien que la relation entre les viandes traitées avec des sels de nitrate-nitrite et le cancer ne soit pas absolue, il est recommandé de modérer votre consommation.
En revanche, les légumes (carottes, betteraves, radis, laitue, épinards, etc.) sont riches en NaNO3 puisqu'ils l'ont absorbé des sols de culture en raison de son action fertilisante. La consommation de ces légumes, contrairement aux produits carnés, n'est pas liée aux maladies susmentionnées.
Cela est dû à deux raisons: la différence des niveaux de protéines de ces aliments et la manière dont ils sont cuits. Lorsque les viandes sont frites ou chauffées à la flamme, la réaction entre les nitrates-nitrites avec certains groupes d'acides aminés est favorisée, pour produire ainsi des nitrosoamines: les vrais cancérogènes.
La teneur en vitamine C, en fibres et en polyphénols des légumes réduit la formation de ces nitrosoamines. C'est pourquoi NaNO3 seul n'est pas une menace pour la nourriture.
Les références
- NOUS. Bibliothèque nationale de médecine. (2019). Nitrate de sodium. Récupéré de: pubchem.ncbi.nlm.nih.gov.
- Encyclopédie Ullmann de chimie industrielle. (1990). Cinquième édition. VCH Verlagsgesellschaft mbH.
- Pouretedal, H.R. et Ravanbod, M. (2015). Etude cinétique de Mg / NaNO3 pyrotechnique utilisant la technique TG / DSC non isotherme. J Therm Anal Calorim (2015) 119: 2281-2288. Récupéré de link.springer.com.
- Jarosz, J. et coll. (2016). Le nitrate de sodium diminue le regroupement des récepteurs de l'acétylcholine induit par l'agrine. BMC Pharmacologie et Toxicologie (2016) 17:20. Récupéré de bmcpharmacoltoxicol.biomedcentral.com.
- Cotton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley et fils.
- Prival, M.J. (2003). Cancer. Cancérogènes dans la chaîne alimentaire. Dans Encyclopédie des sciences alimentaires et de la nutrition (deuxième édition). Récupéré de sciencedirect.com.
- Zakhodyaeva, Y.A. et coll. (2019). Extraction complexe de métaux dans un système aqueux biphasé à base de poly (oxyde d'éthylène) 1500 et de nitrate de sodium. Molecules 2019, 24, 4078. Récupéré de mdpi.com.
- Clements, W.T. et coll. (2014). Ingestion de nitrate: un examen des effets sur la santé et les performances physiques. Nutrients 2014, 6, 5224-5264. Récupéré de mdpi.com.


Personne n'a encore commenté ce post.