
Propriétés, risques et utilisations de l'hydroxyde de baryum (Ba (OH) 2)
le hydroxyde de baryum est un composé chimique de formule Ba (OH)deux(HdeuxOU ALORS)X. C'est une base forte et peut être sous forme anhydre, monohydratée ou octohydratée. La forme monohydratée, également appelée eau de barytine, est la plus courante et la plus utilisée dans le commerce. La structure des composés anhydres et monohydratés est présentée à la figure 1.
L'hydroxyde de baryum peut être préparé en dissolvant l'oxyde de baryum (BaO) dans l'eau: BaO + 9HdeuxO → Ba (OH)deux8HdeuxO. Il cristallise sous forme d'octahydrate, qui devient le monohydrate lorsqu'il est chauffé à l'air. À 100 ° C sous vide, le monohydrate produira du BaO et de l'eau.
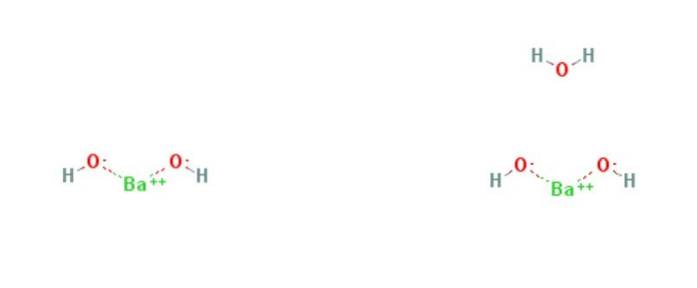
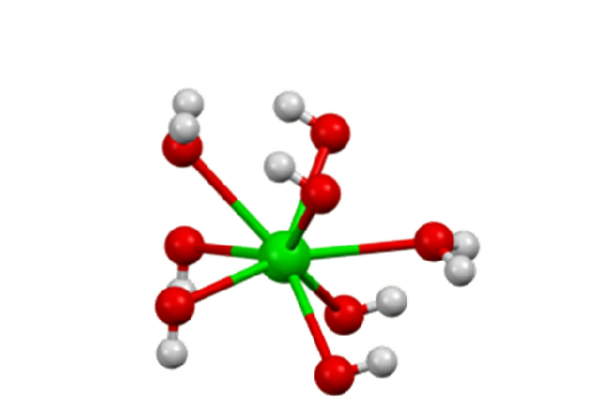
Le monohydrate adopte une structure en couches (figure 2). Les centres Badeux+ ils adoptent une géométrie octaédrique. Chaque centre Badeux+ est lié par deux ligands eau et six ligands hydroxyde, qui sont respectivement doubles et triples pontés aux centres Badeux+ voisins.
Dans l'octahydrate, les centres Badeux+ Les individus ont à nouveau huit coordonnées mais ne partagent pas de ligands (Baryum Hydroxide, S.F.).
Index des articles
- 1 Propriétés de l'hydroxyde de baryum
- 2 Réactivité et dangers
- 2.1 Contact avec les yeux
- 2.2 Contact cutané
- 2.3 Inhalation
- 2.4 Ingestion
- 3 utilisations
- 3.1 1- Industrie
- 3.2 2- Laboratoire
- 3.3 3- Catalyseur dans la réaction de Wittig-Horner
- 3.4 4- Autres utilisations
- 4 Références
Propriétés de l'hydroxyde de baryum
L'hydroxyde de baryum est constitué de cristaux octaédriques blancs ou transparents. Inodore et avec un goût caustique (National Center for Biotechnology Information., 2017). Son aspect est illustré à la figure 3 (IndiaMART InterMESH Ltd., S.F.).

La forme anhydre a un poids moléculaire de 171,34 g / mol, une densité de 2,18 g / ml, un point de fusion de 407 ° C et un point d'ébullition de 780 ° C (Royal Society of Chemistry, 2015).
La forme monohydratée a un poids moléculaire de 189,355 g / mol, une densité de 3,743 g / ml et un point de fusion de 300 ° C (Royal Society of Chemistry, 2015).
La forme octohydrate a un poids moléculaire de 315,46 g / mol, une densité de 2,18 g / ml et un point de fusion de 78 ° C (Royal Society of Chemistry, 2015).
Le composé est légèrement soluble dans l'eau et insoluble dans l'acétone. C'est une base forte avec un pKa de 0,15 et 0,64 pour le premier et le deuxième OH- respectivement.
L'hydroxyde de baryum réagit de manière similaire à l'hydroxyde de sodium (NaOH), mais est moins soluble dans l'eau. Neutralise les acides de manière exothermique pour former des sels et de l'eau. Peut réagir avec l'aluminium et le zinc pour former des oxydes ou des hydroxydes métalliques et générer de l'hydrogène gazeux.
Peut initier des réactions de polymérisation dans des composés organiques polymérisables, en particulier des époxydes.
Il peut générer des gaz inflammables et / ou toxiques avec des sels d'ammonium, des nitrures, des composés organiques halogénés, divers métaux, des peroxydes et des hydroperoxydes. Les mélanges contenant des gommes chlorées explosent lorsqu'ils sont chauffés ou écrasés (BARIUM HYDROXIDE MONOHYDRATE, 2016).
L'hydroxyde de baryum se décompose en oxyde de baryum lorsqu'il est chauffé à 800 ° C. La réaction avec le dioxyde de carbone produit du carbonate de baryum. Sa solution aqueuse hautement alcaline subit des réactions de neutralisation avec des acides. Ainsi, il forme respectivement du sulfate de baryum et du phosphate de baryum avec les acides sulfurique et phosphorique..
HdeuxSW4 + Ba (OH)deux Baso4 + 2HdeuxOU ALORS
La réaction avec le sulfure d'hydrogène produit du sulfure de baryum. La précipitation de nombreux sels de baryum insolubles ou moins solubles peut résulter d'une double réaction de remplacement lorsqu'une solution aqueuse d'hydroxyde de baryum est mélangée avec de nombreuses solutions d'autres sels métalliques..
Le mélange de l'hydroxyde de baryum hydraté solide avec du chlorure d'ammonium solide dans un bêcher produit une réaction endothermique pour produire un liquide, avec dégagement d'ammoniac. La température chute considérablement à environ -20 ° C (Royal Society of Chemistry, 2017).
Ba (OH)deux (s) + 2NH4Cl (s) → BaCldeux (aq) + 2NH3 (g) + HdeuxOU ALORS

Le Ba (OH) 2 réagit avec le dioxyde de carbone pour produire du carbonate de baryum. Ceci est exprimé par la réaction chimique suivante:
Ba (OH) 2 + CO2 → BaCO3 + H2O.
Réactivité et dangers
L'hydroxyde de baryum est classé comme un composé stable et non combustible qui réagit rapidement et exothermiquement avec les acides et est incompatible avec le dioxyde de carbone et l'humidité. Le composé est toxique et, en tant que base forte, est corrosif.
L'inhalation, l'ingestion ou le contact cutané avec le produit peut provoquer des blessures graves ou la mort. Le contact avec la substance fondue peut provoquer de graves brûlures de la peau et des yeux..
Le contact avec la peau doit être évité. Les effets du contact ou de l'inhalation peuvent être retardés. Le feu peut produire des gaz irritants, corrosifs et / ou toxiques. Les eaux usées de lutte contre l'incendie peuvent être corrosives et / ou toxiques et provoquer une contamination.
Lentilles de contact
Si le composé entre en contact avec les yeux, les lentilles de contact doivent être vérifiées et retirées. Les yeux doivent être rincés immédiatement à grande eau pendant au moins 15 minutes, à l'eau froide.
Contact avec la peau
En cas de contact avec la peau, la zone touchée doit être rincée immédiatement pendant au moins 15 minutes avec beaucoup d'eau ou un acide faible, par exemple du vinaigre, tout en retirant les vêtements et les chaussures contaminés. Couvrir la peau irritée d'un émollient.
Lavez les vêtements et les chaussures avant de les réutiliser. Si le contact est sévère, laver avec un savon désinfectant et recouvrir la peau contaminée d'une crème antibactérienne..
Inhalation
En cas d'inhalation, la victime doit être déplacée dans un endroit frais. S'il ne respire pas, la respiration artificielle est pratiquée. Si la respiration est difficile, donnez de l'oxygène.
Ingestion
Si le composé est avalé, le vomissement ne doit pas être provoqué. Desserrez les vêtements serrés comme un col de chemise, une ceinture ou une cravate.
Dans tous les cas, une attention médicale immédiate doit être obtenue (Fiche de données de sécurité Baryum hydroxyde monohydraté, 2013).
Applications
1- Industrie
Industriellement, l'hydroxyde de baryum est utilisé comme précurseur d'autres composés du baryum. Le monohydrate est utilisé pour déshydrater et éliminer le sulfate de divers produits. Cette application exploite la très faible solubilité du sulfate de baryum. Cette application industrielle s'applique également aux utilisations en laboratoire.
L'hydroxyde de baryum est utilisé comme additif dans les thermoplastiques (tels que les résines phénoliques), les rayures et les stabilisants PVC pour améliorer les propriétés du plastique. Ce matériau est utilisé comme additif à usage général pour les lubrifiants et les graisses..
D'autres applications industrielles de l'hydroxyde de baryum comprennent la fabrication de sucre, la fabrication de savons, la saponification des graisses, la fusion du silicate et la synthèse chimique d'autres composés de baryum et de composés organiques (BARIUM HYDROXIDE, S.F.).
2- Laboratoire
L'hydroxyde de baryum est utilisé en chimie analytique pour le titrage d'acides faibles, en particulier d'acides organiques. Sa solution aqueuse limpide est garantie sans carbonate, contrairement à l'hydroxyde de sodium et à l'hydroxyde de potassium car le carbonate de baryum est insoluble dans l'eau.
Cela permet d'utiliser des indicateurs tels que la phénolphtaléine ou la thymolphtaléine (avec des changements de couleur alcaline) sans risque d'erreurs de titrage causées par la présence d'ions carbonate, qui sont beaucoup moins basiques (Mendham, Denney, Barnes, & Thomas, 2000).
L'hydroxyde de baryum est parfois utilisé en synthèse organique comme base forte, par exemple pour l'hydrolyse d'esters et de nitriles:
L'hydroxyde de baryum est également utilisé dans la décarboxylation des acides aminés qui libèrent du carbonate de baryum dans le processus..
Il est également utilisé dans la préparation de cyclopentanone, d 'alcool diacétonique et de gamma - lactone D - Gulonic.
3- Catalyseur dans la réaction de Wittig-Horner
La réaction de Wittig-Horner, également connue sous le nom de réaction de Horner-Wadsworth-Emmons (ou réaction HWE) est une réaction chimique utilisée en chimie organique pour stabiliser les carbanions phosphonates avec des aldéhydes (ou cétones) pour produire principalement des alcènes E (trans).
La réaction soncochimique de Wittig-Horner est catalysée par de l'hydroxyde de baryum activé et est réalisée dans des conditions d'interface solide-liquide..
Le processus soncochimique a lieu à température ambiante et avec un poids de catalyseur et un temps de réaction inférieurs à ceux du processus thermique. Dans ces conditions, on obtient des rendements similaires à ceux du procédé thermique..
Dans les travaux de (J. V. Sinisterra, 1987), l'influence sur les performances du temps de sonication, le poids du catalyseur et du solvant est analysée. De petites quantités d'eau doivent être ajoutées pour que la réaction ait lieu.
La nature du site actif du catalyseur agissant dans le procédé est analysée. Un mécanisme ETC est proposé pour le procédé sonochimique.
4- Autres utilisations
L'hydroxyde de baryum a d'autres utilisations. Il est utilisé à plusieurs fins, telles que:
- La fabrication d'alcali.
- Construction en verre.
- Vulcanisation du caoutchouc synthétique.
- Inhibiteurs de corrosion.
- Comme les fluides de forage, les pesticides et les lubrifiants.
- Pour le remède chaudière.
- Pour affiner les huiles végétales et animales.
- Pour la peinture à fresque.
- Dans l'adoucissement de l'eau.
- En tant qu'ingrédient dans les remèdes homéopathiques.
- Pour nettoyer les déversements d'acide.
- Il est également utilisé dans l'industrie sucrière pour préparer le sucre de betterave.
- Matériaux de construction.
- Produits électriques et électroniques.
- Revêtements de sol.
Les références
- MONOHYDRATE D'HYDROXYDE DE BARYUM. (2016). Récupéré de caméochimiques: cameochemicals.noaa.gov.
- Hydroxyde de baryum. (S.F.). Récupéré de chemistrylearner: chemistrylearner.com.
- HYDROXYDE DE BARYUM. (S.F.). Récupéré de chemicalland21: chemicalland21.com.
- IndiaMART InterMESH Ltd… (S.F.). Hydroxyde de baryum. Récupéré de indiamart: dir.indiamart.com.
- V. Sinisterra, A. F. (1987). Ba (OH) 2 comme catalyseur dans les réactions organiques. 17. Réaction de Wittig-Horner solide-liquide interfaciale dans des conditions sonochimiques. Le Journal de Chimie Organique 52 (17), 3875-3879. researchgate.net.
- Fiche signalétique Hydroxyde de baryum monohydraté. (2013, 21 mai). Récupéré de sciencelab: sciencelab.com/msds.
- Mendham, J., Denney, R. C., Barnes, J. D., et Thomas, M. J. (2000). Analyse chimique quantitative de Vogel (6e éd.). New York: Prentice Hall.
- Centre national d'information sur la biotechnologie. (28 mars 2017). Base de données des composés PubChem; CID = 16211219. Récupéré de PubChem: pubchem.ncbi.nlm.nih.gov.
- Société royale de chimie. (2015). Hydroxyde de baryum. Récupéré de chemspider: chemspider.com.
- Société royale de chimie. (2015). Hydrate d'hydroxyde de baryum (1: 2: 1). Récupéré de chemspider: chemspider.com.
- Société royale de chimie. (2015). Hydrate de dihydroxybarium (1: 1). Récupéré de chemspider: chemspider.com.
- Société royale de chimie. (2017). Réactions endothermiques solide-solide. Récupéré de: learn-chemistry: rsc.org.


Personne n'a encore commenté ce post.