
Structure, propriétés, utilisations, risques de l'oxalate de sodium (Na2C2O4)
le oxalate de sodium C'est un composé organique composé de deux ions sodium et d'un ion oxalate. Sa formule chimique est NadeuxCdeuxOU ALORS4 ou aussi Nadeux(ROUCOULER)deux. C'est le sel de sodium de l'acide oxalique ou de l'acide éthanedioïque. Puis undeuxCdeuxOU ALORS4 est un solide cristallin blanc et ses solutions aqueuses sont basiques (alcalines).
L'oxalate de sodium est présent dans les plantes et les légumes. Chez l'homme, l'acide oxalique est généré naturellement à partir de son acide conjugué, qui à son tour est produit par certains processus métaboliques.

Puis undeuxCdeuxOU ALORS4 Il est utilisé dans les laboratoires d'analyses chimiques comme agent réducteur (le contraire de l'oxydant). Permettre également de tester certains composés organiques lors du traitement des eaux usées.
Il a été utilisé pour l'élimination des déchets de chlorofluorocarbures (CGC), qui endommagent la couche d'ozone. C'est aussi une matière première pour obtenir de l'acide oxalique de manière économique.
En raison de la teneur élevée en oxalate de sodium de certains légumes comestibles, les personnes qui ont tendance à former des calculs rénaux ou des calculs rénaux devraient éviter de consommer de tels aliments. C'est parce que les pierres sont généralement formées avec des oxalates..
Index des articles
- 1 Structure
- 2 Nomenclature
- 3 propriétés
- 3.1 État physique
- 3.2 Poids moléculaire
- 3.3 Densité
- 3.4 Solubilité
- 3,5 pH
- 3.6 Propriétés chimiques
- 4 Obtention
- 4.1 Présence dans la nature
- 5 utilisations
- 5.1 Dans les laboratoires d'analyses chimiques
- 5.2 Lors de la destruction des chlorofluorocarbures
- 5.3 Pour déterminer les paramètres importants du traitement des eaux usées
- 5.4 Pour obtenir de l'acide oxalique
- 5.5 Pour éliminer les composés indésirables
- 6 risques
- 7 Références
Structure
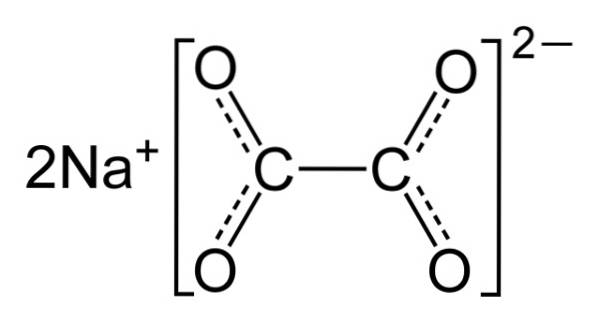
L'oxalate de sodium est composé de deux cations de sodium Na+ et un anion oxalate (COO)deuxdeux-. L'anion oxalate est à son tour composé de deux unités COO- lié par les deux atomes de carbone: -OOC-COO-.
Dans l'oxalate de sodium solide, l'anion oxalate a une forme plate. Cela signifie que les carbones et les oxygènes sont dans le même plan..
Nomenclature
- Oxalate de sodium
- Oxalate de disodium
- Sel de sodium d'acide éthanedioïque
Propriétés
État physique
Cristallin blanc solide.
Poids moléculaire
134,0 g / mol
Densité
2,27 g / cm3 à 20 ° C.
Solubilité
Soluble dans l'eau: 3,7 g / 100 mL à 20 ° C.
pH
Ses solutions aqueuses sont basiques (alcalines) car l'anion oxalate a tendance à prélever les protons de l'eau, laissant les ions OH libres.-.
Propriétés chimiques
Il peut neutraliser les acides et les réactions sont exothermiques, c'est-à-dire qu'elles dégagent de la chaleur.
Il sert d'agent réducteur et dans ces réactions génère du dioxyde de carbone COdeux.
Il a la propriété de se lier fortement à divers ions métalliques tels que les ions fer ferreux Fedeux+ et ferrique Fe3+.
Obtention
Selon une source consultée, l'oxalate de sodium peut être obtenu en oxydant du carbone avec de l'oxygène Odeux à une température d'environ 250 ° C dans une solution concentrée d'hydroxyde de sodium NaOH.
Présence dans la nature
L'oxalate de sodium est présent dans de nombreuses plantes et légumes, tels que les blettes, les épinards et la rhubarbe, et dans les céréales telles que le soja, parmi de nombreux autres produits végétaux..

Son acide conjugué, l'acide oxalique, est produit dans le corps humain par le métabolisme de l'acide glycolique ou de l'acide ascorbique. Une fois produit, il n'est pas métabolisé, mais est excrété dans l'urine sous forme d'oxalate..

Applications
Dans les laboratoires d'analyses chimiques
Il est utilisé comme réactif chimique, généralement comme agent réducteur, par exemple pour la standardisation des solutions de permanganate de potassium, c'est-à-dire pour déterminer exactement la quantité de permanganate de sodium qu'elles contiennent..
Dans la destruction des chlorofluorocarbures
L'oxalate de sodium a été utilisé pour la destruction des chlorofluorocarbures (CFC). Ces composés CFC ont été l'un de ceux responsables de la destruction de la couche d'ozone de la planète (qui nous protège des rayons ultraviolets).
En 1996, certains chercheurs ont proposé l'utilisation d'oxalate de sodium pour les éliminer, car il réagit facilement avec les CFC à des températures de 270 à 290 ° C, les rendant inoffensifs pour la couche d'ozone..
La réaction de l'oxalate de sodium avec les CFC peut être contrôlée pour obtenir des hydrocarbures aromatiques halogénés qui ne sont pas nocifs pour la couche d'ozone mais qui sont des composés utiles dans l'industrie chimique..
Ladite réaction peut également être maximisée et convertir tous les CFC en fluorure de sodium NaF, chlorure de sodium NaCl, carbone élémentaire et dioxyde de carbone CO.deux.

Pour déterminer les paramètres importants du traitement des eaux usées
L'oxalate de sodium s'est avéré utile pour mesurer la quantité et les types de composés organiques sécrétés par des microorganismes à partir de boues utilisées pour traiter les eaux usées..
La mesure de ces composés est importante pour déterminer leur fonction lors du traitement des eaux usées, car la facilité de séparation des boues de l'eau en dépend..
L'utilisation d'oxalate de sodium évite les inconvénients des autres méthodes.
Pour obtenir de l'acide oxalique
L'oxalate de sodium brut de certains déchets de procédé a été utilisé pour produire de l'acide oxalique HdeuxCdeuxOU ALORS4 en grande quantité.
La méthode utilise les boues du procédé Bayer pour traiter la bauxite (un minerai d'aluminium). Dans le procédé Bayer, la bauxite est traitée avec de l'hydroxyde de sodium NaOH pour dissoudre l'alumine de ce minéral.
Dans le processus de dissolution de l'alumine, certains composés organiques présents dans le minéral, tels que les acides humiques, sont attaqués par NaOH, générant une grande quantité d'oxalate de sodium NadeuxCdeuxOU ALORS4.
Cet oxalate de sodium est incorporé dans une boue avec des composés d'aluminium. Pour le purifier, le tout est dissous, filtré et passé sur une colonne échangeuse d'ions de type acide..
Dans la colonne se trouve une résine d'acide sulfonique RSO3H où les ions métalliques sont échangés Na+ par les ions hydrogène H+, donc vous obtenez de l'acide oxalique HdeuxCdeuxOU ALORS4.
RSO3H + NadeuxCdeuxOU ALORS4 ⇔ RSO3Na + NaHCdeuxOU ALORS4
RSO3H + NaHCdeuxOU ALORS4 ⇔ RSO3Na + HdeuxCdeuxOU ALORS4
Il s'agit d'un procédé peu coûteux et l'acide oxalique obtenu est d'une pureté acceptable..
Pour éliminer les composés indésirables
Acide conjugué d'oxalate de sodium, acide oxalique HdeuxCdeuxOU ALORS4, utilisé pour dissoudre certains types de débris et de tartre.
Il profite de la caractéristique de l'acide oxalique pour se transformer en oxalate agissant comme agent complexant ou précipitant, par exemple lors du traitement des déchets de divers combustibles nucléaires..
L'acide oxalique est également utilisé pour éliminer le tartre minéral et les oxydes de fer dans les tuyaux et autres équipements, cela est dû à sa capacité à se lier fortement à la fois l'ion ferreux Fedeux+ quant à l'ion ferrique Fe3+ formation d'oxalates.
Des risques
S'il est directement inhalé ou ingéré, l'oxalate de sodium provoque des douleurs dans la gorge, l'œsophage et l'estomac. Produit des vomissements, des purges sévères, un pouls faible, un collapsus cardiovasculaire, des symptômes neuromusculaires et des lésions rénales.
Les personnes qui ont tendance à former des calculs rénaux en raison de l'accumulation d'oxalate dans l'urine doivent éviter de consommer des légumes à haute teneur en oxalates solubles tels que le sodium..
L'oxalate de sodium en grande quantité dans les aliments lorsqu'il atteint l'urine, se lie au calcium qu'il contient et peut provoquer des calculs rénaux ou des calculs d'oxalate de calcium chez les personnes qui ont tendance à le faire..
Les références
- NOUS. Bibliothèque nationale de médecine. (2019). Oxalate de sodium. Centre national d'information sur la biotechnologie. Récupéré de pubchem.ncbi.nlm.nih.gov.
- Chai, W. et Liebman, M. (2005). Effet de différentes méthodes de cuisson sur la teneur en oxalate de légumes. J. Agric. Food Chem.2005, 53, 3027-3030. Récupéré de pubs.acs.org.
- Dagani, R. (1996). Réaction de destruction des CFC. Archives de nouvelles sur la chimie et l'ingénierie 1996, 74, 4, 6-7. Récupéré de pubs.acs.org.
- Sajjad, M. et Kim, K.S. (2016). Extraction de substances polymères extracellulaires à partir de boues activées à l'aide d'oxalate de sodium. Int. J. Environ. Sci. Technol. 13, 1697-1706 (2016). Récupéré de link.springer.com.
- Jeffrey, G.A. et Parry, G.S. (1954). La structure cristalline de l'oxalate de sodium. J. Am. Chem. Soc 1954, 76, 21, 5283-5286. Récupéré de pubs.acs.org.
- Okuwaki, A. et coll. (1984). Production d'oxalate par oxydation du charbon avec de l'oxygène dans une solution concentrée d'hydroxyde de sodium. Ind. Eng. Chem. Prod. Res. Dev. 1984, 23, 648-651. Récupéré de pubs.acs.org.
- Hefter, G. et coll. (2018). Solubilité de l'oxalate de sodium dans des solutions d'électrolytes concentrées. J Chem & Eng Data. 2018, 63, 3, 542-552. Récupéré de pubs.acs.org.
- Le, K. I. (1992). Procédé de préparation d'acide oxalique et d'hydrogénoxalate de sodium à partir d'oxalate de sodium brut. NOUS. Brevet n ° 5 171 887. 15 décembre 1992. Récupéré de freepatentsonline.com.



Personne n'a encore commenté ce post.