
Structure du peroxyde d'hydrogène (H2O2), propriétés, utilisations, production
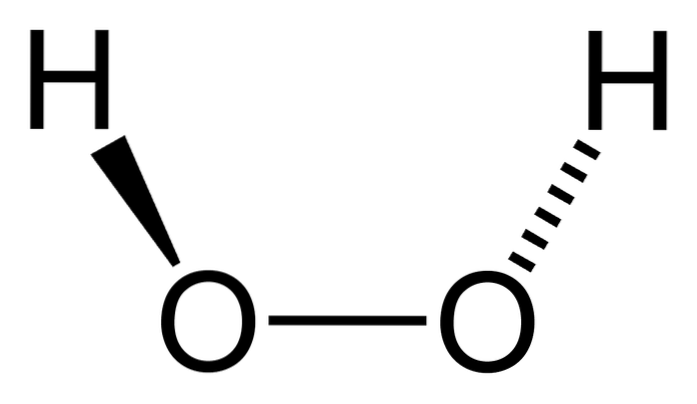
le du peroxyde d'hydrogène est un composé inorganique dont la formule chimique est HdeuxOU ALORSdeux. De tous, c'est le peroxyde le plus simple de cette famille de composés chimiques. Sa formule structurelle est H-O-O-H, étant ce pont oxygéné interne caractéristique de tous les peroxydes.
En 1818, le HdeuxOU ALORSdeux Il a été identifié par Louies Jacques Thénard, qui a préparé un composé chimique qu'il a appelé le peroxyde d'hydrogène à l'époque. C'est un composé instable, il se décompose lors d'une exposition à la lumière, à la chaleur et à certains métaux.
C'est un composé très utile qui est utilisé dans la désinfection des plaies mineures, le blanchiment des cheveux, le traitement de l'eau, etc. Bien qu'il puisse avoir des actions néfastes pour l'homme, il se trouve dans toutes les cellules eucaryotes des êtres vivants, où il remplit plusieurs fonctions bénéfiques..
Le peroxyde d'hydrogène produit l'oxydation de substances toxiques telles que les phénols, l'éthanol, le formaldéhyde, etc., produits qui sont éliminés par le foie et les reins. De plus, il contribue à la destruction des bactéries phagocytées par les leucocytes neutrophiles et les macrophages..
Index des articles
- 1 Structure
- 1.1 Molécule
- 1.2 Rotations
- 1.3 Interactions intermoléculaires
- 2 propriétés
- 2.1 Noms
- 2.2 Masse molaire
- 2.3 Apparence physique
- 2.4 Odeur
- 2.5 Saveur
- 2.6 Densité
- 2.7 Point de fusion
- 2.8 Point d'ébullition
- 2.9 Solubilité dans l'eau
- 2.10 Solubilité
- 2.11 Coefficient de partage octanol / eau
- 2.12 Pression de vapeur
- 2.13 Constante de dissociation
- 2,14 pH
- 2.15 Indice de réfraction (nD)
- 2.16 Viscosité
- 2.17 Capacité calorifique
- 2.18 Chaleur de vaporisation
- 2.19 Stabilité
- 2.20 Corrosion
- 2.21 Décomposition
- 2.22 Tension superficielle
- 2.23 Réactivité
- 3 utilisations
- 3.1 Blanchiment
- 3.2 Désinfectant
- 3.3 Détergent
- 3.4 Application cosmétique
- 3.5 Propulseur
- 4 Obtention
- 4.1 Hydrogénation
- 4.2 Filtration
- 4.3 oxydation
- 4.4 Extraction et purification
- 5 risques
- 6 Références
Structure
Molécule
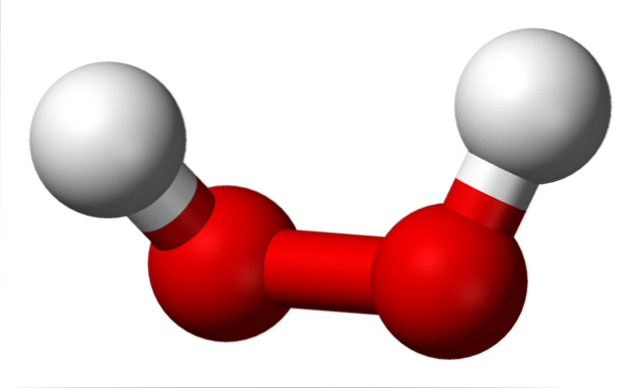
L'image du haut montre la structure de la molécule HdeuxOU ALORSdeux (H-O-O-H), avec les sphères rouges correspondant aux atomes d'oxygène et les blanches aux atomes d'hydrogène. Notez que la molécule n'est pas plate, et que les atomes H ne sont pas éclipsés dans l'espace (l'un devant l'autre).
Fait intéressant, pour le HdeuxOU ALORSdeux Il lui est difficile de faire tourner sa liaison O-O simple centrale, de sorte que les positions de ces H ne peuvent pas être interchangées; l'un ne descendra pas tandis que l'autre montera.
Parce que? Parce que dans les deux atomes d'oxygène, il y a deux paires d'électrons libres, ce qui donne un total de huit électrons très proches qui se repoussent en raison de leurs charges négatives..
Les rotations
Même ainsi, la liaison O-O est sensible à une légère rotation en raison des interactions avec son environnement..
Par exemple, en rapprochant les deux pouces, avec les index étendus et les autres fermés, comme pour dessiner un terrain, puis en tournant les pouces de telle manière que l'un des index pointe vers l'avant et l'autre vers l'arrière, vous avoir une représentation approximative de HdeuxOU ALORSdeux.
Si un corps touche l'un ou l'autre des index, les pouces tourneront en réponse à cette interaction; cependant, ils retourneront immédiatement à leur position d'origine en raison des répulsions électroniques mentionnées ci-dessus. Ces rotations encadrent ainsi les aspects dynamiques de cette molécule.
Interactions intermoléculaires
À l'état liquide, le HdeuxOU ALORSdeux parvient à établir des liaisons hydrogène (HOOH-OdeuxHdeux), car sinon son point d'ébullition élevé (150 ºC) par rapport à l'eau ne serait pas expliqué.
Une fois qu'elle passe en phase gazeuse, les molécules HdeuxOU ALORSdeux vraisemblablement, il ne peut plus former de tels ponts, en raison non seulement de la plus grande distance intermoléculaire, mais aussi les atomes d'hydrogène seraient les premiers à toucher en cas de collisions (cela peut être visualisé en recourant à nouveau au modèle du doigt).
Pendant ce temps, en phase solide, l'angle des plans établis par le H est de 90 ° (placez les index perpendiculairement). Maintenant, les liaisons hydrogène deviennent encore plus importantes et les molécules HdeuxOU ALORSdeux sont disposés dans un cristal de structure tétragonale.
Propriétés
sBouteille avec du peroxyde d'hydrogène. Dans les pharmacies, il est atteint avec une concentration de 3% m / v. Source: Pixnio.
Des noms
-Du peroxyde d'hydrogène
-Antioxidan
-Oxidanol
-Acide perhydroxique
-O-hydroxyol
-Eau oxygénée
Masse molaire
34,0147 g / mol
Apparence physique
Liquide bleu pâle (concentré) ou incolore. Il est légèrement plus visqueux et dense que l'eau. Il est distillé pour la sécurité à basse température et sous pression réduite, car il se décompose en chauffant sous une forme explosive.
Odeur
Odeur forte ou semblable à celle de l'ozone.
Goût
Amer
Densité
Solide 1,71 g / cm3
Les densités de ses solutions aqueuses dépendent de leur concentration; par exemple, à 27%, il a une densité de 1,10 g / cm3, tandis qu'à 50%, 1,13 g / cm3
Point de fusion
- 0,43 ºC
Point d'ébullition
150,2 ° C Cette valeur a été obtenue par extrapolation, car le peroxyde d'hydrogène se décompose à haute température.
Solubilité dans l'eau
Miscible ≥ 100 mg / mL à 25 ºC
Solubilité
Il est soluble dans l'éther et les alcools, mais insoluble dans l'éther de pétrole. Se décompose en eau et en oxygène dans de nombreux solvants organiques.
Coefficient de partage octanol / eau
Log P = - 0,43
La pression de vapeur
5 mmHg à 30 ºC.
Constante de dissociation
pKa = 11,72
pH
Les solutions de peroxyde d'hydrogène sont légèrement acides. Par exemple, un 35% a un pH de 4,6; mais en se concentrant à 90%, le pH devient moins acide: 5,1.
Indice de réfraction (nré)
1 4061
Viscosité
1245 cPois à 20 ºC.
Capacité thermique
1267 J / gK (gaz)
2,619 J / gK (liquide)
Chaleur de vaporisation
1 519 J / gK
Stabilité
Stable dans les conditions recommandées. Il est en outre stabilisé par l'addition d'acétanilide et de sels d'étain.
Corrosion
Corrosif
Décomposition
Il se décompose lors d'une exposition à la lumière ou en présence de substances oxydantes et réductrices. Il se décompose également en chauffant. Lorsqu'il se décompose, il libère de l'eau et de l'oxygène, et est favorisé par une augmentation du pH et de la température, ainsi que par la présence de l'enzyme catalase..
Tension superficielle
80,4 dynes / cm à 20 ° C
Réactivité
Le HdeuxOU ALORSdeux Il agit comme un agent oxydant dans les solutions acides de fer ferreux (Fedeux+) au fer ferrique (F3+); oxyde également l'ion sulfite (SO3deux-) en ion sulfate (SO4deux-).
Il peut également agir comme réducteur en présence de solutions basiques, réduisant l'hypochlorite de sodium (NaOCl) et le permanganate de potassium (KMnO4) avec la libération d'oxygène.
Applications
Blanchiment
Le peroxyde d'hydrogène est utilisé dans l'industrie papetière pour le blanchiment des pâtes et papiers, qui consomme la majeure partie de sa production annuelle.
Désinfectant
Le peroxyde d'hydrogène est un antiseptique doux pour prévenir l'infection des petites plaies, des éraflures et des brûlures. Il est également utilisé comme bain de bouche et pour soulager une légère irritation de la bouche due à la présence d'aphtes ou de gingivite..
Il est également utilisé pour désinfecter les surfaces, l'intérieur des réfrigérateurs, l'eau et lutter contre la prolifération bactérienne excessive dans les systèmes d'eau et les tours de refroidissement. Le peroxyde d'hydrogène libère des radicaux libres d'oxygène, qui décomposent les polluants.
Détergent
Le peroxyde d'hydrogène est utilisé dans la fabrication de détergents de blanchiment, y compris le percarbonate de sodium. Ce composé est un complexe de carbonate de sodium et de peroxyde d'hydrogène qui, lorsqu'il est dissous dans l'eau, se sépare en ses composants.
Application cosmétique
Le peroxyde d'hydrogène dilué est utilisé dans la décoloration des cheveux, avant la coloration. Il est également utilisé pour blanchir les dents, ainsi que dans un dentifrice fait maison.
Propergol
Le peroxyde d'hydrogène est utilisé comme composant monopropulseur ou oxydant d'une fusée bipropolente. Il se décompose en libérant de l'oxygène et de l'eau, une caractéristique qui a permis son utilisation comme propulseur.
Il est pompé dans une cellule de réaction en présence d'un catalyseur qui accélère ladite décomposition. Pendant ce temps, une vapeur d'eau à haute température est produite.
Lorsque la vapeur est expulsée à travers un espace, elle produit une impulsion. Le sous-marin V-80, construit en 1940, utilisait l'oxygène généré par le peroxyde d'hydrogène dans ses turbines; appelé système de turbine de Walter.
Obtention
Initialement, le peroxyde d'hydrogène était obtenu industriellement par hydrolyse du persulfate d'ammonium, [(NH4)deuxSdeuxOU ALORS8] ou l'électrolyse du bisulfate d'ammonium, NH4HSO4.
Le peroxyde d'hydrogène est actuellement obtenu industriellement grâce à l'utilisation d'anthraquinone. Le processus se déroule en quatre étapes: hydrogénation, filtration, oxydation, extraction et purification..
L'hydrogénation
L'alkylantroquinone est hydrogénée en faisant passer de l'hydrogène gazeux à travers un hydrogénateur chargé d'alumine et d'une petite quantité de catalyseur (palladium). La température est maintenue à 45 ºC sous agitation permanente.
L'alkyldroquinone est convertie en alkylanthrahydroquinone et tétrahydroalkylanthrahydroquinone, cette dernière étant choisie pour sa plus grande commodité pour les procédures suivantes.
Filtration
La solution contenant l'anthraquinone hydrogénée est filtrée pour éliminer les traces de catalyseur qu'elle peut contenir..
Oxydation
La solution filtrée est oxydée en y faisant passer de l'air, formant du peroxyde d'hydrogène de faible pureté..
Extraction et purification
La solution avec le peroxyde d'hydrogène passe à travers une colonne d'extraction liquide-liquide. L'eau s'écoule à travers la colonne, tandis que la solution contenant le peroxyde d'hydrogène y est pompée.
L'eau atteint le fond de l'extracteur avec une concentration en peroxyde d'hydrogène comprise entre 25 et 35% p / p. Ensuite, il est purifié par distillation sous vide, à une concentration en peroxyde d'hydrogène de 30%. Enfin stabilise et stocke.
Des risques
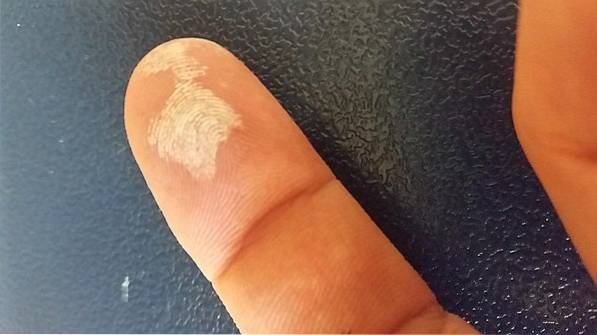
Le peroxyde d'hydrogène est un agent corrosif, donc au contact de la peau, il provoque une irritation sévère, ainsi qu'un blanchiment temporaire (image ci-dessus). Il peut également causer des lésions oculaires, des démangeaisons, une éruption cutanée, des rougeurs et des cloques..
L'inhalation provoque une irritation du nez, de la gorge et des poumons. Pendant ce temps, une exposition répétée peut provoquer une bronchite, une toux, des mucosités et un essoufflement. Et comme si cela ne suffisait pas, cela génère également des maux de tête, des étourdissements, des nausées et des vomissements.
Une exposition sévère au peroxyde d'hydrogène peut provoquer une accumulation de liquide dans les poumons, appelée œdème pulmonaire - une affection grave qui nécessite une attention médicale rapide..
L'Occupational Safety and Health Administration (OSHA) a établi le maximum autorisé pour le peroxyde d'hydrogène de 1 ppm dans un environnement de travail sur un quart de huit heures. Cependant, comme il s'agit d'un composé mutagène, l'exposition doit être réduite au minimum..
Les références
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2019). Peroxyde d'hydrogène. Récupéré de: en.wikipedia.org
- William R. Busing et Henri A. Levy. (2004). Cristal et structure moléculaire du peroxyde d'hydrogène: un neutron - étude de diffraction. doi.org/10.1063/1.1696379
- Centre national d'information sur la biotechnologie. (2019). Peroxyde d'hydrogène. Base de données PubChem. CID = 784. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Les rédacteurs de l'Encyclopaedia Britannica. (27 novembre 2018). Peroxyde d'hydrogène. Encyclopædia Britannica. Récupéré de: britannica.com
- Département de la santé du New Jersey. (2016). Peroxyde d'hydrogène. [PDF]. Récupéré de: nj.gov
- Mathews, C. K., Van Holde, K. E., Ahern, K. G. (2002). Biochimie. Troisième édition. Éditeur Pearson Addison Wesley
- Web MD. (2019). Peroxyde d'hydrogène. Récupéré de: webmd.com


Personne n'a encore commenté ce post.