
Propriétés des peroxydes, nomenclature, utilisations, exemples
Les peroxydes sont tous ces composés chimiques qui contiennent le groupe peroxo, O-O, soit lié de manière covalente à des atomes de carbone ou à d'autres groupes fonctionnels, soit sous forme ionique telle que l'anion peroxyde, Odeuxdeux-. Ce qui précède est représenté graphiquement dans l'image ci-dessous. Dans celui-ci, le groupe O-O est mis en évidence avec une couleur bleue.
Il peut y avoir des peroxydes organiques tels que les peroxydes de diakyle (R1-O-O-Rdeux), les hydroperoxydes (R-O-O-H), les peracides (RCO-O-O-H) et les peresters (R1CO-O-O-Rdeux). Nous avons également des peroxydes inorganiques, tels que les peroxydes métalliques (Mn+OU ALORSdeuxdeux-) et le peroxyde d'hydrogène (H-O-O-H). Ce dernier est le plus connu de tous, recevant le nom de peroxyde d'hydrogène.
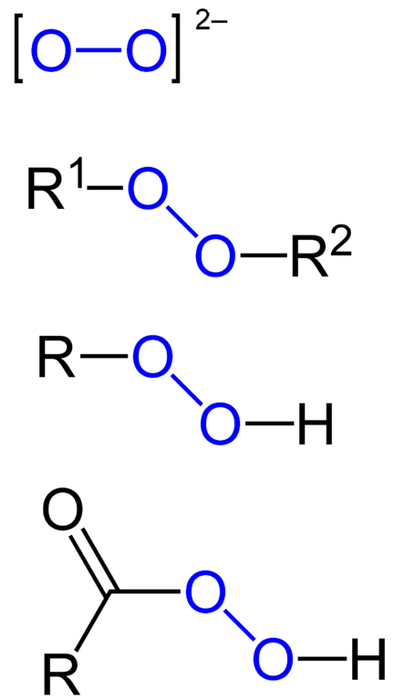
Tous les peroxydes ont en commun la propriété d'être des substances hautement réactives, oxydantes et, dans certains cas, explosives. À moins d'être synthétisés, ils sont considérés comme des impuretés indésirables et dangereuses pour de nombreux procédés industriels et pour la synthèse en laboratoire..
Les peroxydes en général sont d'excellents agents oxydants, blanchissants, bactéricides et activateurs de polymérisations via la formation de radicaux libres. C'est pourquoi ce sont généralement des réactifs ou additifs très utiles dans l'industrie des polymères, ainsi que dans l'industrie alimentaire pour accélérer l'oxydation et éliminer les bactéries..
Index des articles
- 1 Propriétés des peroxydes
- 1.1 Structure
- 1.2 Réactivité
- 1.3 Action oxydante
- 1.4 Sensibilité
- 2 Nomenclature
- 3 Formation
- 4 utilisations des peroxydes
- 4.1 Initiateurs de polymérisation
- 4.2 Agents de blanchiment et désinfectants
- 4.3 Agents oxydants
- 4.4 Sources d'oxygène
- 5 Exemples de peroxydes
- 6 Références
Propriétés des peroxydes
Structure
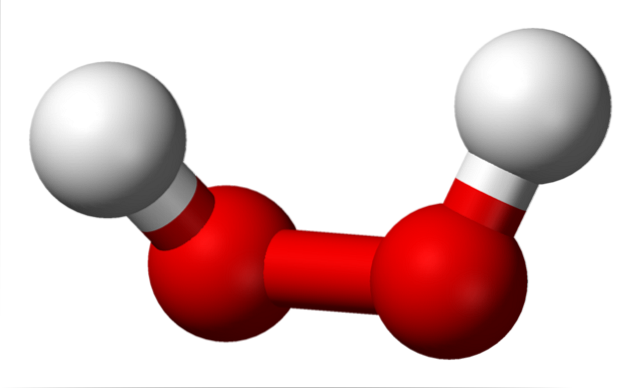
Les structures des peroxydes sont centrées autour du groupe O-O. Chaque atome d'oxygène a une hybridation sp3, ainsi les liaisons -O-O- ne reposent pas sur le même plan. Par exemple, pour le peroxyde d'hydrogène, H-O-O-H, l'angle formé entre les deux H est de 115,5 °, ce qui montre que les quatre atomes ne sont pas sur un plan..
Les distorsions de cet angle et d'autres dépendront de l'identité des autres fragments moléculaires liés au groupe O-O..
En revanche, les peroxydes organiques et inorganiques (à l'exception des peroxydes métalliques) peuvent être reconnus à l'œil nu si le groupe O-O est détaillé dans leur structure, comme deux verres avec une «bouche». De cette manière, tout peroxyde est immédiatement identifié d'un simple coup d'œil sur sa structure..
Réactivité
La liaison O-O est relativement faible par rapport à d'autres liaisons telles que C-H ou C-O. C'est pourquoi il a tendance à se décomposer ou à se fragmenter pour produire des radicaux oxygénés hautement réactifs..
C'est à cause de ces radicaux que les peroxydes sont classés comme substances réactives et dangereuses, car ils peuvent endommager les tissus et toute matière organique en général..
Action oxydante
Les peroxydes sont de puissants agents oxydants, cherchant à obtenir des électrons de l'environnement pour les transformer en eau, oxygène ou hydroxydes. Par exemple, le peroxyde d'hydrogène est un agent oxydant plus puissant que le permanganate de potassium lui-même..
Cette action oxydante permet de les détecter grâce à leur réaction avec le sulfate ferreux et le thiocyanate de potassium:
Peroxyde + Fedeux+ + SCN- → Fe (SCN)n(3-n)- (n = 1 à 6).
Le complexe formé entre le Fe3+ et le SNA- il est de couleur rouge sang, donc l'observation de cette couleur correspond à un test positif pour la présence de peroxydes dans l'échantillon.
Sensibilité
Les peroxydes sont des substances sensibles aux températures élevées et à la lumière du soleil. Par conséquent, ils doivent être stockés dans des endroits sûrs et dans des récipients en plastique opaque, de manière à ce que la lumière ne brille pas directement sur eux..
Nomenclature
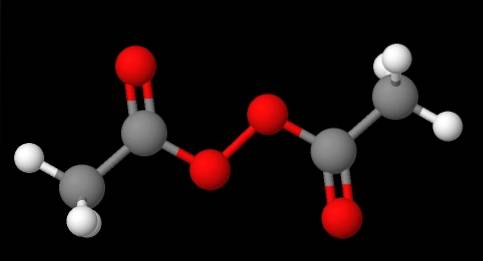
La nomenclature des peroxydes dépend du type auquel ils appartiennent. En général, beaucoup sont nommés en mentionnant «peroxyde» suivi des substituants R dans l'ordre alphabétique. Par exemple, le composé CH3C (O) OOC (O) CH3 (image du bas) est appelé peroxyde de diacétyle ou d'acétyle, car il a un groupe acétyle à chaque extrémité.
Composé C6H5C (O) OOC (O) C6H5 (image du bas), d'autre part, il est appelé peroxyde de dibenzoyle ou de benzoyle, pour les mêmes raisons expliquées dans le paragraphe précédent.
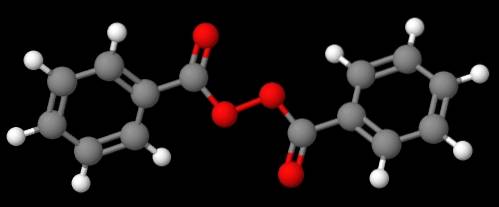
Pendant ce temps, le composé C6H5C (O) OOC (O) CH3 Il est appelé peroxyde d'acétylbenzoyle. Cette fois, le substituant acétyle est mentionné en premier en commençant par la lettre «a». Un autre exemple est le CH3CHdeuxOOC6H5, appelé peroxyde d'éthylphényle.
De la même manière, nous procédons avec les hydroperoxydes. Par exemple, le CH3OOH est appelé hydroperoxyde de méthyle.
Formation
Certains peroxydes peuvent être formés directement par exposition de la substance en question à l'oxygène de l'air, assisté ou non de catalyseurs métalliques. Ils peuvent également être formés en exposant la substance à l'ozone dans certaines conditions, en effectuant la réaction d'ozonolyse..
Une autre voie de synthèse consiste à faire réagir le peroxyde d'hydrogène avec un sulfate d'alkyle:
RdeuxSW4 + HdeuxOU ALORSdeux → R-O-O-R + HdeuxSW4
Pour synthétiser ou former des peroxydes de dialkyle ou même des peroxydes cycliques.
Pendant ce temps, plusieurs des méthodes pour former des peroxydes métalliques sont basées sur l'oxygénation de leurs oxydes métalliques respectifs, de sorte qu'ils «oxygènent» et cessent d'être MO (Mn+OU ALORSdeux-) l'amourdeux (Mn+OU ALORSdeuxdeux-).
Utilisations des peroxydes
Initiateurs de polymérisation
Des peroxydes, en particulier des peroxydes organiques, sont ajoutés aux milieux réactionnels pour la synthèse d'infinités de plastiques et de matériaux tels que le polystyrène, le silicone, les résines époxy et acryliques, le polychlorure de vinyle, la fibre de verre, entre autres.
En effet, ils subissent des décompositions thermiques pour devenir des radicaux libres oxygénés, qui à leur tour déclenchent et catalysent les polymérisations. Par conséquent, ils sont souhaitables dans l'industrie des polymères..
Certains des peroxydes utilisés comme initiateurs sont le peroxyde de méthyléthylcétone (MEK) et le peroxyde d'acétone.
Agents de blanchiment et désinfectants
Les peroxydes sont des agents de blanchiment utilisés pour le blanchiment de la pâte à papier et de la farine. De même, ce sont des agents désinfectants, totalement efficaces bien qu'agressifs en termes d'extermination des bactéries. L'exemple classique correspond au peroxyde d'hydrogène, utilisé en solutions diluées (3%) pour désinfecter les plaies..
Agents oxydants
Les peroxydes sont également des agents oxydants, ils trouvent donc de nombreuses utilisations dans les synthèses organiques de substances hautement oxygénées..
Sources d'oxygène
Bien qu'il ne fasse pas partie de ses principales utilisations, les peroxydes peuvent également servir de sources d'oxygène dans certaines de ses décompositions. C'est le cas, encore une fois, du peroxyde d'hydrogène.
Exemples de peroxydes
Enfin, quelques exemples de peroxydes, qu'ils soient organiques ou inorganiques, avec leurs formules et leurs noms respectifs seront listés:
-HdeuxOU ALORSdeux: peroxyde d'hydrogène ou peroxyde d'hydrogène
-N / AdeuxOU ALORSdeux: peroxyde de sodium
-Faisceaudeux: peroxyde de baryum
-C6H5C (CH3)deuxOOH: hydroperoxyde de cumène
-(NH4)deuxSdeuxOU ALORS8: Persulfate d'ammonium
- HO3SOOSO3H: acide peroxydisulfurique
-(CH3)3COOC (CH3)3: peroxyde de ditert-butyle
Les références
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organique. (dixe édition.). Wiley plus.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2020). Peroxyde organique. Récupéré de: en.wikipedia.org
- Elsevier B.V. (2020). Peroxyde. ScienceDirect. Récupéré de: sciencedirect.com
- Développement de chimie avancée. (s.f.). Alcools, phénols et leurs dérivés:
- Règle des peroxydes C-218. Récupéré de: acdlabs.com
- Vol'nov I.I., Petrocelli A.W. (1966) Classification et nomenclature des composés de peroxyde inorganique. Dans: Petrocelli A.W. (eds) Peroxydes, superoxydes et ozonides de métaux alcalins et alcalino-terreux. Springer, Boston, MA.


Personne n'a encore commenté ce post.