
Structure et fonction des cellules sèches
Ongle pile sèche c'est une batterie dont le milieu électrolytique est constitué d'une pâte et non d'une solution. Cependant, ladite pâte présente un certain taux d'humidité et, pour ces raisons, elle n'est pas strictement sèche..
Le peu d'eau est suffisant pour que les ions se déplacent et, par conséquent, le flux d'électrons à l'intérieur de la cellule..

Son énorme avantage par rapport aux premières batteries humides est que, comme il s'agit d'une pâte électrolytique, son contenu ne peut pas être renversé; ce qui était le cas des batteries humides, qui étaient plus dangereuses et délicates que leurs homologues sèches. Compte tenu de l'impossibilité des déversements, la cellule sèche est utilisée dans de nombreux appareils portables et mobiles.
Dans l'image ci-dessus, il y a une batterie sèche zinc-carbone. Plus exactement, il s'agit d'une version moderne de la pile Georges Leclanché. De tous, c'est le plus courant et peut-être le plus simple.
Ces appareils représentent une commodité énergétique en raison du fait qu'ils ont de l'énergie chimique dans la poche qui peut être transformée en électricité; et de cette manière, ne pas dépendre des prises de courant ou de l'énergie fournie par les grandes centrales électriques et leur vaste réseau de pylônes et de câbles.
Index des articles
- 1 Structure de la cellule sèche
- 1.1 Électrodes
- 1.2 Terminaux
- 1.3 Sable et cire
- 2 Fonctionnement
- 2.1 Oxydation de l'électrode de zinc
- 2.2 Réduction du chlorure d'ammonium
- 2.3 Télécharger
- 3 Références
Structure cellulaire sèche
Quelle est la structure d'une cellule sèche? Sur l'image, vous pouvez voir son couvercle, qui n'est rien de plus qu'un film polymère, de l'acier, et les deux bornes dont les rondelles isolantes dépassent de l'avant.
Cependant, ce n'est que son apparence extérieure; ses pièces les plus importantes se trouvent à l'intérieur, ce qui garantit son bon fonctionnement.
Chaque pile sèche aura ses propres caractéristiques, mais seule la pile zinc-carbone sera considérée, dont une structure générale pour toutes les autres piles peut être esquissée..
La batterie est comprise comme l'union de deux batteries ou plus, et ces dernières sont des cellules voltaïques, comme cela sera expliqué dans une section ultérieure..
Électrodes
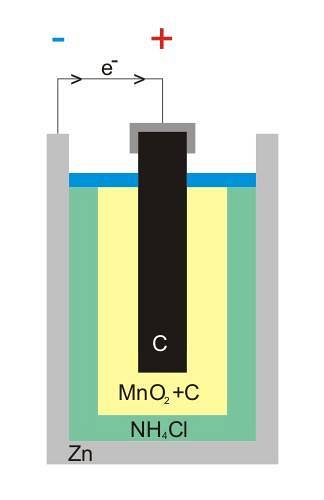
L'image du haut montre la structure interne d'une batterie zinc-carbone. Quelle que soit la cellule voltaïque, il devrait toujours y avoir (généralement) deux électrodes: une à partir de laquelle les électrons sont émis et une autre qui les reçoit..
Les électrodes sont des matériaux électriquement conducteurs, et pour qu'il y ait du courant, les deux doivent avoir des électronégativités différentes.
Par exemple, le zinc, une boîte blanche qui renferme la batterie, est l'endroit où les électrons partent pour le circuit électrique (appareil) où il est connecté.
D'autre part, dans tout le milieu se trouve l'électrode de carbone graphitique; également immergé dans une pâte composée de NH4Cl, ZnCldeux et MnOdeux.
Cette électrode est celle qui reçoit les électrons, et notez qu'elle porte le symbole '+', ce qui signifie que c'est la borne positive de la batterie.
Terminaux
Comme on le voit au-dessus de la tige de graphite dans l'image, il y a la borne électrique positive; et en dessous, le zinc intérieur peut à partir duquel les électrons circulent, la borne négative.
C'est pourquoi les piles ont des marques «+» ou «-» pour indiquer la bonne façon de les connecter à l'appareil et ainsi lui permettre de s'allumer..
Sable et cire
Bien que non représentée, la pâte est protégée par un sable tampon et un sceau de cire qui l'empêche de se renverser ou d'entrer en contact avec l'acier sous des chocs mécaniques mineurs ou une agitation..
Fonctionnement
Comment fonctionne une cellule sèche? Pour commencer, c'est une cellule voltaïque, c'est-à-dire qu'elle génère de l'électricité à partir de réactions chimiques. Par conséquent, dans les cellules, des réactions d'oxydoréduction se produisent, où les espèces gagnent ou perdent des électrons..
Les électrodes servent de surface qui facilite et permet le développement de ces réactions. En fonction de leurs charges, une oxydation ou une réduction des espèces peut se produire.
Pour mieux comprendre cela, seuls les aspects chimiques de la batterie zinc-carbone seront expliqués..
Oxydation des électrodes de zinc
Dès que l'appareil électronique est allumé, la batterie libère des électrons en oxydant l'électrode de zinc. Cela peut être représenté par l'équation chimique suivante:
Zn => Zndeux+ + 2e--
S'il y a beaucoup de Zndeux+ entourant le métal, une polarisation de charge positive se produira, il n'y aura donc plus d'oxydation. Par conséquent, le Zndeux+ doit diffuser à travers la pâte vers la cathode, où les électrons rentreront.
Une fois que les électrons ont activé l'artefact, ils retournent à l'autre électrode: celle en graphite, pour trouver des espèces chimiques «en attente»..
Réduction du chlorure d'ammonium
Comme indiqué précédemment, il y a du NH dans les pâtes4Cl et MnOdeux, substances qui rendent son pH acide. Dès que les électrons entrent, les réactions suivantes se produisent:
2NH4+ + 2e- => 2NH3 + Hdeux
Les deux produits, l'ammoniac et l'hydrogène moléculaire, NH3 et Hdeux, ce sont des gaz, et donc ils peuvent "gonfler" la batterie s'ils ne subissent pas d'autres transformations; tels que les deux suivants:
Zndeux+ + 4NH3 => [Zn (NH3)4]deux+
Hdeux + 2MnOdeux => 2MnO (OH)
Notez que l'ammonium a été réduit (électrons gagnés) pour devenir NH3. Ces gaz ont ensuite été neutralisés par les autres composants de la pâte..
Le complexe [Zn (NH3)4]deux+ facilite la diffusion des ions Zndeux+ vers la cathode et ainsi empêcher la batterie de «caler».
Le circuit externe de l'artefact fonctionne comme un pont pour les électrons; sinon, il n'y aurait jamais de connexion directe entre la boîte de zinc et l'électrode en graphite. A l'image de la structure, ce circuit représenterait le câble noir.
Télécharger
Les cellules sèches sont disponibles dans de nombreuses variantes, tailles et tensions de fonctionnement. Certains d'entre eux ne sont pas rechargeables (cellules voltaïques primaires), tandis que d'autres le sont (cellules voltaïques secondaires).
La batterie zinc-carbone a une tension de fonctionnement de 1,5 V. Leurs formes changent en fonction de leurs électrodes et de la composition de leurs électrolytes..
Il viendra un moment où tout l'électrolyte a réagi, et peu importe combien le zinc est oxydé, il n'y aura aucune espèce qui recevra les électrons et favorisera leur libération..
De plus, il peut être le cas où les gaz formés ne sont plus neutralisés et restent en exerçant une pression à l'intérieur des batteries..
Les piles zinc-carbone et les autres piles non rechargeables doivent être recyclées; car ses composants, en particulier les composants nickel-cadmium, sont nocifs pour l'environnement en polluant les sols et les eaux.
Les références
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE.
- La batterie "Dry-Cell". Récupéré de: makahiki.kcc.hawaii.edu
- Hoffman S. (10 décembre 2014). Qu'est-ce qu'une pile sèche? Récupéré de: upsbatterycenter.com
- Mauvaises herbes, Geoffrey. (24 avril 2017). Comment fonctionnent les piles sèches? Découvrir. Récupéré de: scaimer.com
- Woodford, Chris. (2016) Batteries. Récupéré de: explainthatstuff.com.


Personne n'a encore commenté ce post.