
Potentiomètre (pH-mètre) À quoi ça sert et comment ça marche

UNE potentiomètre est l'appareil utilisé pour mesurer la différence de potentiel entre une électrode de travail et une électrode de référence, lorsque les deux sont immergées dans une solution dont on souhaite déterminer son acidité ou basicité, exprimée en pH.
De cette manière, la potentiométrie fait référence à la méthode analytique utilisée pour déterminer la concentration en ions H.+ dans une substance en solution, en utilisant un potentiomètre et les deux électrodes précitées.

Dans le cas de l'électrode de référence, elle présente un potentiel connu, constant et stable contrairement à l'électrode de travail. Le potentiel qui se développe dans cette dernière électrode varie proportionnellement à la concentration en ions H+ qui sont dans la solution.
Ce potentiel est également fortement influencé par la température à laquelle la mesure est effectuée..
Index des articles
- 1 À quoi ça sert?
- 2 Comment ça marche?
- 2.1 Électrodes
- 2.2 Calibrer un potentiomètre
- 3 Références
Pourquoi est-ce?
Il existe un grand nombre de procédés mis en œuvre dans le domaine industriel - comme la production de médicaments, la transformation des aliments et la purification de l'eau - qui sont très sensibles aux variations de pH. Pour cette raison, sa mesure correcte est si importante.
Comme mentionné précédemment, le pH est un paramètre utilisé pour mesurer l'acidité ou l'alcalinité d'une solution qui se trouve dans la phase aqueuse en analysant la concentration en ions H.+ en solution. Ensuite, la valeur du pH est calculée par l'équation suivante:
pH = -log [H+]
Ainsi, le potentiomètre est utilisé pour mesurer le pH d'une substance en solution..
Lorsque le potentiomètre est connecté aux deux électrodes immergées dans la solution à analyser, il détecte la différence de potentiel entre l'électrode de travail et l'électrode de référence, amplifiant ce signal et le convertissant en une valeur de pH à l'aide de l'équation décrite ci-dessus..
Comment ça marche?
Le fonctionnement d'un potentiomètre est basé sur le mécanisme d'une cellule électrochimique, où les ions H sont impliqués+ dans la réaction chimique de la cellule pour déterminer la concentration de ces ions dans la solution et, de cette manière, obtenir le pH de la même.
Lorsqu'on souhaite mesurer le pH d'une solution par potentiométrie, on utilise un potentiomètre et une électrode; le premier est le dispositif qui détermine le pH, tandis que le second est basé sur la combinaison d'une électrode de référence et d'une électrode de mesure sensible aux analytes.
En ce sens, un circuit est formé à travers lequel le courant électrique circule entre les électrodes et la solution, où elles remplissent la fonction d'une batterie lorsqu'elles sont immergées dans la solution mentionnée..
De cette manière, le potentiomètre est conçu pour générer une tension égale à zéro (en millivolts) lorsqu'il a un pH égal à sept; c'est-à-dire neutre.
De même, lorsqu'une augmentation des valeurs potentielles est enregistrée (avec des nombres positifs), cela signifie qu'il y a des valeurs de pH plus basses, et lorsqu'une diminution est observée - c'est-à-dire une croissance vers des nombres négatifs - on parle de valeurs plus élevées. PH.
Électrodes
L'électrode de mesure (ou de travail) est constituée d'un dispositif où se déroule la réaction à l'étude (oxydation ou réduction).
Bien qu'il existe de nombreux types, il s'agit généralement de verre, constitué d'une membrane de verre très mince qui a une perméabilité aux ions H.+ de l'environnement dans lequel il se trouve.
En plaçant celui-ci dans une solution qui a un pH différent de celui de la solution présente dans la cellule, une différence de potentiel est générée entre les deux faces de la membrane et cette différence peut être enregistrée au moyen d'une électrode de référence..
D'autre part, l'électrode de référence est un dispositif qui présente des caractéristiques de potentiel stable et de valeur connue, qui est normalement utilisée comme anode dans la cellule électrochimique..
Un exemple de ce type d'électrode est celui qui est constitué d'un fil d'argent, qui est recouvert de chlorure d'argent et immergé dans une solution d'acide chlorhydrique dilué, ou l'électrode de référence saturée de calomel, comme celle représentée sur la figure ci-dessous.
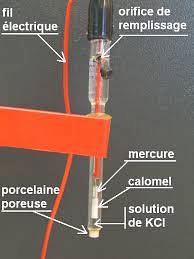
Ainsi, le potentiomètre détermine la différence de potentiel qui est générée entre les électrodes, bien que seul le potentiel de l'électrode de travail dépende des concentrations des espèces ioniques..
Calibrer un potentiomètre
L'étalonnage d'un potentiomètre doit être effectué au moyen de solutions tampons connues (également appelées tampons ou solutions tampons), qui consistent en des systèmes à pH pratiquement invariable contenant une substance faible et ses espèces conjuguées..
Chaque tampon a un pH spécifique, qui peut être acide (pH<7), básico (pH>7) ou neutre (pH = 7), et peuvent être achetés dans le commerce déjà standardisés ou préparés en laboratoire avec des réactifs certifiés et en utilisant des procédures établies et validées..
Comme les potentiomètres mesurent la valeur du pH dans une plage considérée comme large, il faut savoir si l'analyte a un pH supérieur ou inférieur à sept pour procéder à son étalonnage correct..
Ainsi, pour les échantillons dont le pH est censé être basique, il doit être étalonné avec une solution tampon avec un pH égal à sept et une autre avec un pH plus élevé (normalement un pH de dix est utilisé)..
En revanche, pour les échantillons avec un pH acide attendu, il est étalonné avec une solution tampon avec un pH égal à sept et une autre avec un pH inférieur (normalement un pH quatre est utilisé)..
Enfin, le recalibrage de cet instrument de mesure doit être effectué avant et après chaque utilisation, en enregistrant ses résultats, notamment la date et l'heure de leur réalisation et les caractéristiques des solutions tampons utilisées pour le contrôler..
Les références
- Wikipédia. (s.f.). pH-mètre. Obtenu sur es.wikipedia.org
- Chang, R. (2007). Chimie, neuvième édition. (McGraw-Hill).
- Westcott, C. (2012). Mesures de pH. Obtenu sur books.google.co.ve
- Nielsen, C. (1996). Gérer le laboratoire analytique: clair et simple. Obtenu sur books.google.co.ve
- Kenkel, J. (2010). Chimie analytique pour les techniciens, troisième édition. Obtenu sur books.google.co.ve
- Câble, M. (2005). Calibration: un guide du technicien. Obtenu sur books.google.co.ve



Personne n'a encore commenté ce post.