
Propriétés périodiques des éléments et leurs caractéristiques

le Propriétés périodiques des éléments sont ceux qui définissent leur comportement physique et chimique d'un point de vue atomique, et dont les grandeurs, en plus du numéro atomique, permettent une classification des atomes.
De toutes les propriétés, celles-ci sont caractérisées, comme leur nom l'indique, comme périodiques; c'est-à-dire que si le tableau périodique est étudié, il sera possible de certifier que ses grandeurs obéissent à une tendance qui coïncide et se répète avec l'ordre des éléments en périodes (lignes) et en groupes (colonnes).

Par exemple, si une période est parcourue et qu'une propriété périodique diminue en magnitude avec chaque élément, la même chose lui arrivera dans toutes les périodes. D'un autre côté, si descendre un groupe ou une colonne augmente son ampleur, on peut s'attendre à ce que la même chose se produise pour les autres groupes..
Et ainsi, ses variations se répètent et montrent une tendance simple qui s'accorde avec l'ordre des éléments par leurs numéros atomiques. Ces propriétés sont directement responsables du caractère métallique ou non métallique des éléments, ainsi que de leurs réactivités, ce qui a permis de les classer plus en profondeur..
Si pendant un instant l'identité des éléments était inconnue et qu'ils étaient vus comme d'étranges "sphères", le tableau périodique pourrait être reconstruit (avec beaucoup de travail) en utilisant ces propriétés.
De cette façon, les sphères supposées acquériraient des couleurs qui leur permettraient de se différencier les unes des autres en groupes (image du haut). Connaissant leurs caractéristiques électroniques, ils pourraient être organisés en périodes, et les groupes révéleraient ceux qui ont le même nombre d'électrons de valence.
Apprendre et raisonner sur les propriétés périodiques revient à savoir pourquoi les éléments réagissent d'une manière ou d'une autre; est de savoir pourquoi les éléments métalliques sont dans certaines régions de la table, et les éléments non métalliques dans une autre.
Index des articles
- 1 Quelles sont les propriétés périodiques et leurs caractéristiques
- 1.1 -Rayon atomique
- 1.2 -Électronégativité
- 1.3 - Caractère métallique
- 1.4 - Énergie d'ionisation
- 1.5 - Affinité électronique
- 2 Références
Quelles sont les propriétés périodiques et leurs caractéristiques
-Radio atomique
En observant les sphères dans l'image, la première chose que l'on peut remarquer est qu'elles ne sont pas toutes de la même taille. Certains sont plus volumineux que d'autres. Si vous regardez de plus près, vous constaterez que ces tailles varient selon un schéma: dans une période, elle diminue de gauche à droite, et dans un groupe, elle augmente de haut en bas..
Ce qui précède peut également être dit de cette façon: le rayon atomique diminue vers les groupes ou colonnes de droite, et augmente dans les périodes ou lignes inférieures. Ceci étant le cas, le rayon atomique est la première propriété périodique, puisque ses variations suivent un modèle à l'intérieur des éléments..
Charge nucléaire vs électrons
Pourquoi ce modèle? Dans une période, les électrons de l'atome occupent le même niveau d'énergie, qui est lié à la distance qui les sépare du noyau. Lorsque nous passons d'un groupe à un autre (ce qui revient à passer par la période à droite), le noyau ajoute à la fois des électrons et des protons dans le même niveau d'énergie..
Par conséquent, les électrons ne peuvent pas occuper plus de distances du noyau, ce qui augmente sa charge positive car il a plus de protons. Par conséquent, les électrons subissent une plus grande force d'attraction vers le noyau, les attirant de plus en plus à mesure que le nombre de protons augmente..
C'est pourquoi les éléments à l'extrême droite du tableau périodique (colonnes jaunes et turquoises) ont les plus petits rayons atomiques..
Par contre, lorsque vous «sautez» d'une période à une autre (ce qui revient à dire que vous descendez d'un groupe), les nouveaux niveaux d'énergie activés permettent aux électrons d'occuper des espaces plus éloignés du noyau. Étant plus éloigné, le noyau (avec plus de protons) les attire avec moins de force; et les rayons atomiques augmentent donc.
Rayons ioniques
Les rayons ioniques suivent un modèle similaire aux rayons atomiques; Cependant, ceux-ci ne dépendent pas tellement du noyau, mais du nombre d'électrons ou moins de l'atome par rapport à son état neutre..
Les cations (Na+, ACdeux+, Au3+, Êtredeux+, Foi3+) présentent une charge positive car ils ont perdu un ou plusieurs électrons, et par conséquent, le noyau les attire avec plus de force car il y a moins de répulsions entre eux. Le résultat: les cations sont plus petits que les atomes dont ils sont dérivés.
Et pour les anions (Odeux-, F-, Sdeux-, je-) au contraire, ils présentent une charge négative car ils ont un ou plusieurs électrons en excès, augmentant leurs répulsions les uns envers les autres au-dessus de l'attraction exercée par le noyau. Le résultat: les anions sont plus gros que les atomes dont ils sont issus (image ci-dessous).
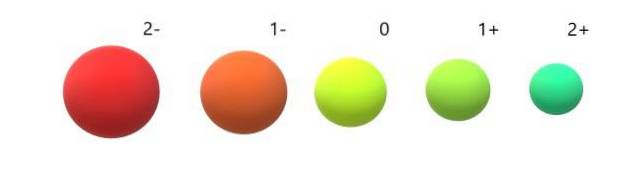
On comprend que l'anion 2 est le plus volumineux de tous et le cation 2+ le plus petit. Les rayons augmentent lorsque l'atome est chargé négativement et se contracte lorsqu'il est chargé positivement..
-Électronégativité
Lorsque les éléments ont de petits rayons atomiques, non seulement leurs électrons sont très fortement attirés, mais aussi les électrons des atomes voisins lorsqu'ils forment une liaison chimique. Cette tendance à attirer les électrons d'autres atomes au sein d'un composé est connue sous le nom d'électronégativité..
Ce n'est pas parce qu'un atome est petit qu'il sera plus électronégatif. Si tel est le cas, les éléments hélium et hydrogène seraient les atomes les plus électronégatifs. L'hélium, pour autant que la science l'a montré, ne forme aucune liaison covalente d'aucune sorte; et l'hydrogène, n'a qu'un seul proton dans le noyau.
Lorsque les rayons atomiques sont grands, les noyaux n'ont pas assez de force pour attirer les électrons d'autres atomes; par conséquent, les éléments les plus électronégatifs sont ceux avec un petit rayon atomique et un plus grand nombre de protons.
Encore une fois, ceux qui remplissent parfaitement ces caractéristiques sont les éléments non métalliques du bloc p du tableau périodique; Ce sont ceux appartenant au groupe 16 ou oxygène (O, S, Se, Te, Po), et au groupe 17 ou fluor (F, Cl, Br, I, At).
Tendance
D'après tout ce qui a été dit, les éléments les plus électronégatifs se situent surtout dans le coin supérieur droit du tableau périodique; ayant le fluor comme élément en tête de la liste des plus électronégatifs.
Parce que? Sans recourir à des échelles d'électronégativité (Pauling, Mulliken, etc.), bien que le fluor soit plus gros que le néon (le gaz rare de son époque), le premier peut former des liaisons tandis que le second ne le peut pas. De plus, pour sa petite taille, son noyau a de nombreux protons, et là où se trouve le fluor, il y aura un moment dipolaire.
-Caractère métallique
Si un élément a un rayon atomique comparé à ceux de sa même période, et n'est pas non plus très électronégatif, alors c'est un métal, et a un caractère métallique élevé.
Si l'on revient à l'image principale, les sphères rougeâtres et verdâtres, comme les grisâtres, correspondent à des éléments métalliques. Les métaux ont des caractéristiques uniques, et à partir de là, les propriétés périodiques commencent à s'entremêler avec les propriétés physiques et macroscopiques de la matière..
Les éléments à fort caractère métallique sont caractérisés par leurs atomes relativement gros, faciles à perdre des électrons car les noyaux peuvent difficilement les attirer vers eux..
En conséquence, ils sont facilement oxydés ou perdus des électrons pour former des cations, M+; cela ne veut pas dire que tous les cations sont métalliques.
Tendance
À ce stade, vous pouvez prédire comment le caractère métallique varie dans le tableau périodique. Si l'on sait que les métaux ont de grands rayons métalliques, et qu'ils sont aussi peu électronégatifs, il faut s'attendre à ce que les éléments les plus lourds (les périodes inférieures) soient les plus métalliques; et les éléments les plus légers (les périodes supérieures), les moins métalliques.
De plus, le caractère métallique diminue à mesure que l'élément devient électronégatif. Cela signifie qu'en parcourant les périodes et les groupes à droite du tableau périodique, dans leurs périodes supérieures, ils trouveront les éléments les moins métalliques..
Par conséquent, le caractère métallique augmente en descendant dans un groupe et diminue de gauche à droite au cours de la même période. Parmi les éléments métalliques, nous avons: Na (sodium), Li (lithium), Mg (magnésium), Ba (baryum), Ag (argent), Au (or), Po (polonium), Pb (plomb), Cd (cadmium ), Al (aluminium), etc..
-Énergie d'ionisation
Si un atome a un grand rayon atomique, il faut s'attendre à ce que son noyau ne retienne pas les électrons dans les coquilles les plus externes piégées avec une force considérable. Par conséquent, les éliminer de l'atome en phase gazeuse (individualisé) ne nécessitera pas beaucoup d'énergie; c'est-à-dire l'énergie d'ionisation, EI, nécessaire pour en retirer un électron.
EI équivaut également à dire que c'est l'énergie qui doit être fournie pour vaincre la force d'attraction du noyau d'un atome ou d'un ion gazeux sur son électron le plus externe. Plus l'atome est petit et plus électronégatif, plus son IE est bas; c'est ta tendance.
L'équation suivante illustre un exemple:
Na (g) => Na+(g) + e-
L'EI nécessaire pour y parvenir n'est pas terrible par rapport à la deuxième ionisation:
N / A+(g) => Nadeux+(g) + e-
Depuis à Na+ les charges positives prédominent et l'ion est plus petit que l'atome neutre. Par conséquent, le noyau de Na+ attire les électrons avec une force beaucoup plus grande, nécessitant un IE beaucoup plus grand.
-Affinité électronique
Et enfin, il y a la propriété périodique de l'affinité électronique. C'est la tendance énergétique de l'atome d'un élément en phase gazeuse à accepter un électron. Si l'atome est petit et a un noyau avec une grande force d'attraction, il lui sera facile d'accepter l'électron, formant un anion stable..
Plus l'anion est stable par rapport à son atome neutre, plus son affinité électronique est grande. Cependant, les répulsions entre les électrons eux-mêmes entrent également en jeu.
L'azote, par exemple, a une affinité électronique plus élevée que l'oxygène. C'est parce que ses trois électrons 2p ne sont pas appariés et se repoussent et l'électron entrant moins; tandis que dans l'oxygène, il y a une paire d'électrons appariés qui exercent une plus grande répulsion électronique; et en fluor, il y a deux paires.
C'est pour cette raison que la tendance des affinités électroniques se normaliserait à partir de la troisième période du tableau périodique..
Les références
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE.
- Prof. Ortega Graciela M. (1er avril 2014). Propriétés périodiques des éléments. Couleur abc. Récupéré de: abc.com.py
- Chimie LibreTexts. (7 juin 2017). Propriétés périodiques des éléments. Récupéré de: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (02 janvier 2019). Les propriétés périodiques des éléments. Récupéré de: thinkco.com
- Toppr. (s.f.). Propriétés périodiques des éléments. Récupéré de: toppr.com /
- Propriétés périodiques des éléments: Un voyage à travers la table est un voyage à travers la chimie. [PDF]. Récupéré de: cod.edu



Personne n'a encore commenté ce post.