
Structure chimique, propriétés et utilisations du propylène

le propylène ou le propène à température ambiante et pression atmosphérique est à l'état gazeux et, comme les autres alcènes, est incolore. Il a une odeur similaire à celle de l'huile mais moins intense. Il présente un moment dipolaire car, bien qu'il manque une liaison polaire forte, sa molécule est asymétrique.
De même, le propylène est un isomère structurel du cyclopropane (ils ont la même formule chimique C3H6). Il se produit dans la nature à la suite des processus de végétation et de fermentation. Il est produit artificiellement lors du traitement des combustibles fossiles tels que le pétrole, le gaz naturel et, dans une moindre mesure, le carbone.

De même, l'éthylène et le propylène sont des produits du raffinage du pétrole dans un processus de division de grosses molécules d'hydrocarbures pour générer de petits hydrocarbures très demandés..
Le propylène peut également être obtenu en utilisant différentes méthodologies:
- En faisant réagir de manière réversible de l'éthylène et du butène, où les doubles liaisons sont rompues et reformulées pour donner du propylène.
- Par un processus de déshydrogénation (perte d'hydrogène) du propane.
- Dans le cadre d'un programme de production d'oléfines à partir de méthanol (MTO), le propylène a été produit à partir de méthanol. Celui-ci est passé à travers le catalyseur zéolitique, ce qui favorise sa déshydratation et conduit à la formation d'éthylène et de propylène..
3CH3OH (méthanol) => CH3CH = CHdeux (propylène) + 3HdeuxO (eau)
Index des articles
- 1 Structure chimique
- 2 propriétés
- 2.1 Poids moléculaire
- 2.2 Point d'ébullition
- 2.3 Point de fusion
- 2.4 Point d'éclair
- 2.5 Solubilité
- 2.6 Solubilité exprimée en masse
- 2.7 Densité
- 2.8 Densité de vapeur
- 2.9 Pression de vapeur
- 2.10 Auto-inflammation
- 2.11 Viscosité
- 2.12 Chaleur de combustion
- 2.13 Chaleur de vaporisation
- 2.14 Tension superficielle
- 2.15 Polymérisation
- 2.16 Point de congélation
- 2.17 Seuil olfactif
- 3 utilisations
- 3.1 Polypropylène
- 3.2 Acrylonitrile
- 3.3 Oxyde de propylène
- 3.4 Pour la synthèse d'alcools et autres utilisations
- 4 Références
Structure chimique
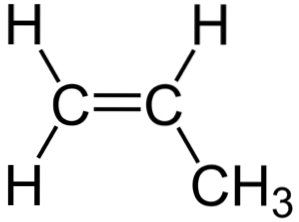
Dans l'image du haut, vous pouvez voir la structure chimique du propylène, dans laquelle son asymétrie se démarque (le côté droit est différent de celui de gauche). Son squelette carboné, à l'exclusion des atomes H, peut être vu comme un boomerang.
Ce boomerang a une insaturation ou une double liaison sur l'un de ses côtés (le C1) et est donc plate en raison de l'hybridation spdeux d'atomes de carbone.
Cependant, l'autre côté est occupé par le groupe méthyle (-CH3), dont l'hybridation est sp3 et a une géométrie tétraédrique. Ainsi, vu de face, le boomerang est plat avec les atomes H en saillie à environ 109,5 °.
En phase gazeuse, la molécule interagit faiblement avec les autres par des forces de dispersion. De même, les interactions entre les doubles liaisons (π-π) de deux molécules de propylène sont empêchées par le groupe méthyle.
Cela se traduit par une diminution de ses forces intermoléculaires, ce qui se reflète dans ses propriétés physiques. Ce n'est qu'à de très basses températures que le propylène peut adopter une structure solide, dans laquelle les boomerang restent groupés avec leurs faibles interactions.
Propriétés
C'est un gaz incolore avec une odeur aromatique. Il est transporté sous forme de gaz liquéfié et, lorsqu'il s'échappe des conteneurs qui le contiennent, il le fait sous forme de gaz ou de liquide. A de faibles concentrations, il forme un mélange explosif et inflammable avec l'air, la densité du propylène étant supérieure à celle de l'air..
Poids moléculaire
42,081 g / mol
Point d'ébullition
53,9 ° F à 760 mmHg
48 ºC à 760 mmHg
Point de fusion
301,4 ºF
185 ºC
point de rupture
162 ° F
Solubilité
44,6 ml / 100 ml dans l'eau.
1250 ml / 100 ml dans l'éthanol.
524,5 ml / 100 ml dans l'acide acétique.
Solubilité exprimée en masse
200 mg / l à 25 ºC
Densité
0,609 mg / ml à -52,6 ° F
0,5139 à 20 ° C
Densité de vapeur
1,46 à 32 ° F (par rapport à l'air pris comme référence).
1,49 (air = 1).
1,91 kg / m3 à 273,15 ºK
La pression de vapeur
1 mmHg à -205,4 ° F
760 mmHg à -53,9 ° F
8,69 × 103 mmHg à 25 ºC (valeur extrapolée).
1158 kPa à 25 ºC
15,4 atm à 37 ºC
Auto-inflammation
851 ° F
455 ºC
Viscosité
83,4 micropoises à 16,7 ºC.
Chaleur de combustion
16 692 BTU / lb
10 940 cal / g
Chaleur de vaporisation
104,62 cal / g (au point d'ébullition)
Tension superficielle
16,7 dynes / cm à 90 ° C
Polymérisation
Polymérise à haute température et haute pression en présence de catalyseurs.
Point de congélation
185,25 ° C.
Seuil d'odeur
10 à 50 mg / m3 (détection)
100 mg / m3 (reconnaissance)
Applications
Il est utilisé dans l'industrie pétrochimique comme carburant et agent d'alkylation. Dans l'industrie chimique, il est utilisé comme matière première pour la production et la synthèse de nombreux dérivés.
Il est principalement utile dans la production de polypropylène, d'acrylonitrile (ACN), d'oxyde de propylène (PO), d'alcools, de cumène et d'acides acryliques.
Polypropylène
Le polypropylène est l'une des principales matières plastiques utilisées dans l'électronique et les accessoires électriques, les articles ménagers, les capsules de bouteilles et les valises..
Le matériau laminé est utilisé dans l'emballage de bonbons, d'étiquettes, de disques compacts, etc., tandis que les fibres sont utilisées pour fabriquer des chemises et des vêtements..
Acrylonitrile
Les polymères et fibres élastomères sont obtenus à partir d'acrylonitrile. Ces fibres sont utilisées pour la fabrication de différentes formes de vêtements, tels que des pulls, des chaussettes et des vêtements de sport. Ils sont également utilisés dans l'ameublement, les dossiers, les tissus d'ameublement, les coussins et les couvertures..
OXID de propylène
L'oxyde de propylène participe en tant que composant à la synthèse du polyuréthane. Ceci est utilisé dans la fabrication de mousse flexible et de mousse rigide. La mousse flexible est utilisée comme charge dans les meubles de maison et dans l'industrie automobile.
D'autre part, la mousse rigide est principalement utilisée comme matériau d'isolation des bâtiments..
De plus, l'oxyde de propylène est utilisé dans la production de propylène glycol. Ce composé est utilisé dans la fabrication de résines polyester insaturées et comme antigel..
De plus, l'oxyde de propylène est utilisé dans la production d'éther de propylène glycol. Cet éther a une application dans la fabrication de peintures, vêtements, encres, résines et nettoyants.
Pour la synthèse d'alcool et d'autres utilisations
Le propylène permet l'obtention de certains alcools, parmi lesquels l'isopropanol, utilisé comme solvant dans les cosmétiques et les produits de soins personnels. De plus, il remplit la fonction d'agent antiseptique.
- L'isopropanol est impliqué dans la fabrication de peintures, résines, encres et rubans adhésifs. Il est également utilisé dans l'industrie pharmaceutique.
- L'oxo-alcool2-éthylhexanol est utilisé dans la production de phtalates, de plastifiants, de matériaux adhésifs et de peintures.
- Le butanol est utilisé dans la fabrication de peintures, revêtements, résines, colorants, produits pharmaceutiques et polymères.
D'autre part, le cumène est produit à partir de la combinaison de propylène et de benzène. Le cumène est le principal composé dans la fabrication du phénol et de l'acétone, utilisé dans une variété de produits, tels que les polycarbonates, les résines phénoliques, les résines époxy et le méthacrylate de méthyle..
Enfin, l'acide acrylique - un autre produit dérivé du propylène - est utilisé dans la production d'esters et de résines acryliques pour les applications de peinture, de revêtement et d'adhésif..
Les références
- Michal Osmenda. (26 décembre 2007). Allumez mon feu. [Chiffre]. Extrait le 23 mai 2018 de: commons.wikimedia.org
- Le groupe Linde. (2018). Propylène. Extrait le 23 mai 2018 de: linde-gas.com
- Wikipédia. (2018). Propène. Extrait le 23 mai 2018 de: en.wikipedia.org
- PubChem. (2018). Propylène. Extrait le 27 mai 2018 de: pubchem.ncbi.nlm.nih.gov
- Vesovic Velisa. (7 février 2011). Propylène. Extrait le 27 mai 2018 de: thermopedia.com
- Jeffrey S. Plotkin. (2016, 8 août). Le dilemme du propylène. Extrait le 27 mai 2018 de: acs.org
- ICIS. (6 novembre 2017). Utilisations du propylène et données sur le marché. Extrait le 27 mai 2018 de: icis.com


Personne n'a encore commenté ce post.