
Quelles bases chimiques peuvent être trouvées dans la maison?
le bases chimiques Ils sont présents dans un grand nombre de produits pour un usage quotidien à la maison et dans certains aliments que vous n'imaginez peut-être même pas. Après tout, la science est partout.
Quand j'ai commencé mes études de chimie à l'université, un de mes professeurs nous a exhortés à être curieux et investigateurs, qualités qui caractérisent un bon scientifique..

Inspiré par ses mots, j'ai pris un rouleau de papier tournesol et j'ai commencé à mesurer le pH de tout ce que j'avais dans ma maison. La vérité est que j'ai été très surpris par la quantité de choses qui avaient un pH basique à la maison.
En fait, je me souviens que la seule chose qui a changé le papier tournesol en rouge était la sauce tomate ketchup (ce qui a du sens puisque ses ingrédients sont la tomate et le vinaigre).
Comme je l'ai mentionné dans d'autres articles, une base est un composé chimique ayant la capacité d'accepter des protons, de donner un hydroxyle ou de posséder une paire d'électrons libres. Ils ont la propriété de neutraliser les acides, d'augmenter le pH d'une solution et de bleuir le papier de tournesol..
Les fondations sont très importantes dans l'utilisation quotidienne et passent souvent inaperçues. Sans bases, les taches persistantes sur les vêtements ne se décolleraient pas, vous auriez des miroirs sales et même des problèmes intestinaux tels que le reflux gastrique et la constipation ne pourraient pas être atténués (SPM Chemistry Form 4 Notes - Acids and Bases (Part 2), 2013).
Ci-dessous je donne une liste de bases d'usage quotidien qui à l'époque, donnaient une couleur bleue au papier de tournesol. Toutes ces bases sont dans les produits d'usage quotidien et alimentaire (Acids vs. Bases, S.F.).
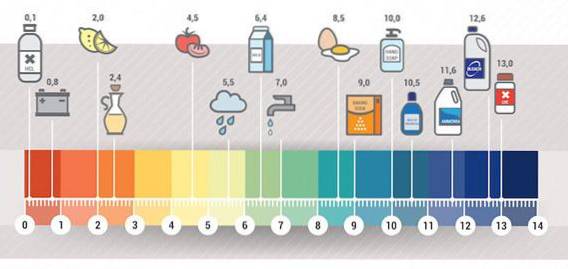
Exemples de bases que l'on trouve dans la maison
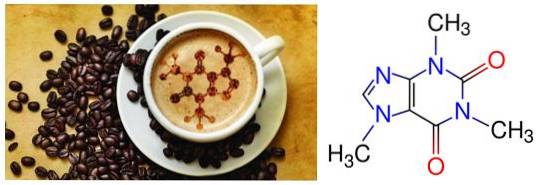
1- Café et thé: la molécule de caféine (1,3,7 triméthylxanthine) porte son nom car elle a été découverte dans les grains de café.
Plus tard, il a été découvert qu'il existe également dans les feuilles de thé en concentration plus élevée. Cette molécule, une purine très similaire à l'adénine et, comme elle, est une base azotée.
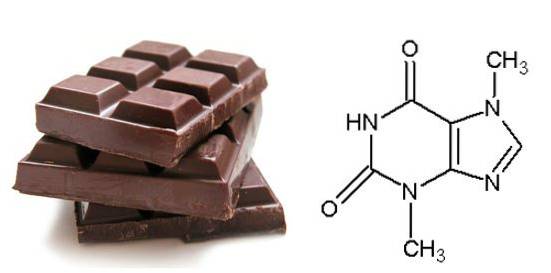
2- ChocolatSemblable au café, le chocolat contient un composé appelé théobromine qui est une base azotée purine.
Ce composé est responsable du goût du chocolat si bon, cependant, les chats et les chiens ne métabolisent pas la théobromine, ce qui endommage le cœur et le système nerveux central. En conclusion, ne donnez jamais de chocolat à votre animal de compagnie (Reactions, 2016).
3- Chlore: le chlore est en fait de l'hypochlorite ou du chlorite de sodium, selon qu'il s'agit de chlore de piscine ou de chlore pour laver les vêtements.
Les ions hypochlorite et chlorite sont les bases conjuguées des acides hypochloreux et chloreux respectivement qui, en solution aqueuse, ont la capacité de prélever des protons de l'eau, augmentant la concentration d'hydroxyle dans le milieu (Acides et bases - Applications réelles, S.F.).
ClO- + HdeuxO → HClO + OH-
ClOdeux- + HdeuxO → HClOdeux + Oh-
4- Eau de Javel: La base la plus résistante disponible dans le commerce, nettoie les fours et débouche les tuyaux. L'eau de Javel, ou hydroxyde de sodium (NaOH), est un composant principal des nettoyeurs de drains, liquéfiant les déchets afin qu'ils puissent être lavés à travers les tuyaux.
Les nettoyants pour four à base d'eau de javel caustique coupent le matériau cuit au four. Doit être manipulé avec précaution car il peut provoquer de graves brûlures chimiques.

Le bicarbonate de soude est sans danger au toucher. Boire quelques pincées de bicarbonate de soude dissout dans l'eau neutralisera une partie de l'excès d'acide dans votre estomac. Il fait également un agent de nettoyage légèrement abrasif et non toxique.
6- Borax: également connu sous le nom de tétraborate de sodium (NadeuxB4O7 ● 10HdeuxO) a autrefois aidé à préserver les momies dans l'Égypte ancienne. Maintenant, il garde les vêtements frais et tue les parasites à la maison. Son pH de 9,2 signifie qu'elle est 920 fois plus alcaline que l'eau pure.
Le borax apporte un ion oxygène à l'eau pour former du peroxyde d'hydrogène (HdeuxOU ALORSdeux) en solution, ce qui en fait un désinfectant et un agent de blanchiment doux.
Évitez de manipuler le borax directement ou pendant trop longtemps car il peut provoquer une irritation cutanée. Le borax est légèrement toxique s'il est ingéré. (Whitney, 2017).
7- Ammoniac: le terme «ammoniac» désigne à la fois un gaz irritant (NH3) ainsi que le produit de nettoyage (NH4OH) qui résulte de la dissolution de l'ammoniac dans l'eau. L'ammoniac domestique a un pH de 11, soit 50 fois plus fort que celui du lait de magnésie.
C'est un nettoyant ménager puissant qui nettoie pratiquement toutes les surfaces de saleté et de graisse (Cascio, 2017).

9- Lait de magnésie: Cet antiacide et laxatif commun tire son nom laiteux de son opacité. Hydroxyde de magnésium [Mg (OH)deux] a un pH de 10,5. Les préparations commerciales de lait de magnésie utilisent des arômes de menthe ou de fruits pour masquer le goût amer caractéristique des substances alcalines..
10- Antiacides: L'utilisation de bases faibles pour soulager les brûlures d'estomac est courante. Des composés tels que le bicarbonate de sodium (NaHCO3), carbonate de magnésium (MgCO3), carbonate de calcium (CaCO3) et hydroxyde d'aluminium (Al (OH)3) sont les ingrédients actifs des antiacides.
11- Déodorants- L'hydroxyde d'aluminium est également l'ingrédient actif des déodorants. Il agit comme un bactéricide, éliminant les bactéries qui se nourrissent des protéines et des graisses de la sueur qui sont sécrétées par les glandes apocrines (Reaction, 2015).
12- Savon: le savon est le produit de la neutralisation de l'hydroxyde de sodium et de l'acide stéarique. Ce dernier est un acide gras saturé à 18 atomes de carbone.

Le produit de cette neutralisation est le stéarate de sodium, qui en solution aqueuse forme l'ion stéarate.
Cette molécule contient une partie polaire et une partie non polaire, c'est pourquoi elle est connue sous le nom de molécule amphipathique et est responsable de l'élimination des graisses et autres composés aliphatiques des vêtements ou du corps..
Les références
- Acides et bases - Applications réelles. (S.F.). Récupéré de scienceclarified.com.
- Acides vs. Bases. (S.F.). Récupéré de acides-vs-bases.weebly.com.
- Cascio, C. (25 avril 2017). Exemples concrets d'acides et de bases. Récupéré de scaimer.com.
- (2015, 21 septembre). Comment fonctionnent les déodorants et les antisudorifiques? . Récupéré de youtube.com.
- Réactions. (18 janvier 2016). Pourquoi le chocolat est-il mauvais pour les chiens?? . Récupéré de youtube.com.
- Notes du Formulaire 4 de Chimie SPM - Acides et Bases (Partie 2). (2013, 2 mars). Récupéré de berryberryeasy.com.
- Whitney, L. (25 avril 2017). Bases utilisées comme produits ménagers courants. Récupéré de scaimer.com.



Personne n'a encore commenté ce post.