
Quel est le point d'équivalence et à quoi sert-il?
le point d'équivalence C'est celui dans lequel deux substances chimiques ont complètement réagi. Dans les réactions acide-base, ce point indique quand un acide ou une base entier a été neutralisé. Ce concept est le pain quotidien des titrages ou des évaluations volumétriques, et est déterminé au moyen de calculs mathématiques simples.
Mais quel est le diplôme? C'est un processus dans lequel un volume d'une solution de concentration connue, appelée titrant, est soigneusement ajouté à une solution de concentration inconnue, afin d'obtenir sa concentration.

L'utilisation d'un indicateur de pH permet de connaître le moment où le titrage se termine. L'indicateur est ajouté à la solution qui est titrée pour effectuer la quantification de la concentration que l'on souhaite connaître. Un indicateur acido-basique est un composé chimique dont la couleur dépend de la concentration en hydrogène ou du pH du milieu..
Cependant, le décalage de couleur de l'indicateur indique le point final du titrage, mais pas le point d'équivalence. Idéalement, les deux points devraient coïncider; mais en réalité, le changement de couleur peut se produire en quelques gouttes après que la neutralisation de l'acide ou de la base soit terminée..
Index des articles
- 1 Quel est le point d'équivalence?
- 1.1 Point final
- 2 Point d'équivalence du titrage d'un acide fort avec une base forte
- 3 Courbe de titrage acide-base forte faible
- 3.1 Étapes
- 3.2 Sélection de l'indicateur en fonction du point d'équivalence
- 4 Références
Quel est le point d'équivalence?
Une solution d'un acide de concentration inconnue placée dans un ballon peut être titrée en ajoutant lentement une solution d'hydroxyde de sodium de concentration connue à l'aide d'une burette..
Le choix d'un indicateur doit être fait de telle manière qu'il change de couleur au moment où la même quantité d'équivalents chimiques de la solution titrante et de la solution de concentration inconnue ont réagi..
C'est le point d'équivalence, tandis que le point auquel un indicateur change de couleur est appelé le point final, où le titrage se termine..
Point final
L'ionisation ou la dissociation de l'indicateur est représentée comme suit:
HIn + HdeuxOU ALORS <=> Dans- + H3OU ALORS+
Et a donc une constante Ka
Ka = [H3OU ALORS+] [Dans-] / [HIn]
La relation entre l'indicateur non dissocié (HIn) et l'indicateur dissocié (In-) détermine la couleur de l'indicateur.
L'ajout d'un acide augmente la concentration de HIn et produit la couleur indicatrice 1. Parallèlement, l'ajout d'une base favorise une augmentation de la concentration de l'indicateur dissocié (In-) (couleur 2).
Il est souhaitable que le point d'équivalence corresponde au point final. Pour ce faire, un indicateur est sélectionné avec un intervalle de changement de couleur qui inclut le point d'équivalence. De plus, il essaie de réduire les erreurs qui produisent une différence entre le point d'équivalence et le point final.
La standardisation ou le titrage d'une solution est un processus où la concentration exacte d'une solution est déterminée. C'est méthodologiquement un diplôme, mais la stratégie suivie est différente.
Une solution de l'étalon primaire est placée dans le ballon et la solution de titrant qui est normalisée est ajoutée avec une burette..
Point d'équivalence du titrage d'un acide fort avec une base forte
100 mL de HCl 0,1 M sont placés dans le ballon et une solution de NaOH 0,1 M est progressivement ajoutée à travers une burette, déterminant les changements de pH de la solution à l'origine de l'acide chlorhydrique.
Initialement, avant d'ajouter NaOH, le pH de la solution HCl est de 1.
La base forte (NaOH) est ajoutée et le pH augmente progressivement, mais il s'agit toujours d'un pH acide, car un excès d'acide détermine ce pH.
Si vous continuez à ajouter du NaOH, il arrive un moment où le point d'équivalence est atteint, où le pH est neutre (pH = 7). L'acide a réagi avec la base consommée, mais il n'y a pas encore de base en excès.
La concentration de chlorure de sodium, qui est un sel neutre (ni Na+ ni le Cl- hydrolyser).
Si vous continuez à ajouter du NaOH, le pH continue d'augmenter, devenant plus basique que le point d'équivalence, car la concentration de NaOH prédomine..
Idéalement, le changement de couleur de l'indicateur devrait se produire à pH = 7; mais en raison de la forme nette de la courbe de titrage, la phénolphtaléine peut être utilisée qui se transforme en rose pâle à un pH d'environ 8.
Faible courbe de titrage acide-base forte
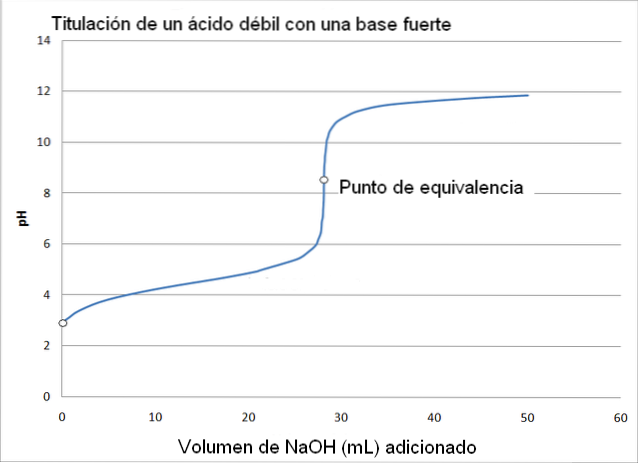
Dans ce cas, un acide faible, tel que l'acide acétique (CH3COOH) avec une base forte, l'hydroxyde de sodium (NaOH). La réaction qui se produit lors du titrage peut être décrite comme suit:
NaOH + CH3COOH => CH3ROUCOULER-N / A+ + HdeuxOU ALORS
Dans ce cas, le tampon acétate est formé avec un pKa = 4,74. La région tamponnée peut être vue dans le léger et presque imperceptible changement avant pH 6.
Le point d'équivalence, comme l'indique l'image, se situe autour de 8,72 et non de 7. Pourquoi? Parce que le CH3ROUCOULER- est un anion qui, après hydrolyse, génère OH-, qui basifie le pH:
CH3ROUCOULER- + HdeuxOU ALORS <=> CH3COOH + OH-
Étapes
Le titrage de l'acide acétique par l'hydroxyde de sodium peut être divisé en 4 étapes pour l'analyse.
-Avant de commencer à ajouter la base (NaOH), le pH de la solution est acide et dépend de la dissociation de l'acide acétique.
-Au fur et à mesure que de l'hydroxyde de sodium est ajouté, la solution tampon acétate se forme, mais de la même manière la formation de la base conjuguée acétate augmente, ce qui entraîne une augmentation du pH de la solution..
-Le pH du point d'équivalence se produit à un pH de 8,72, ce qui est franchement alcalin..
Le point d'équivalence n'a pas de valeur constante et varie en fonction des composés impliqués dans le titrage..
-Au fur et à mesure que vous ajoutez du NaOH, après avoir atteint le point d'équivalence, le pH augmente en raison d'un excès d'hydroxyde de sodium.
Sélection de l'indicateur en fonction du point d'équivalence
La phénolphtaléine est utile pour déterminer le point d'équivalence dans ce titrage, car elle a son point de virage de couleur à un pH d'environ 8, qui tombe dans la zone de pH du titrage d'acide acétique qui comprend l'équivalence du point (pH = 8,72).
D'autre part, le rouge de méthyle n'est pas utile pour déterminer le point d'équivalence, car il change de couleur dans la plage de pH de 4,5 à 6,4.
Les références
- Wikipédia. (2018). Point d'équivalence. Récupéré de: es.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (22 juin 2018). Définition du point d'équivalence. Récupéré de: thinkco.com
- Lusi Madisha. (16 avril 2018). Différence entre le point final et le point d'équivalence. " DifferenceBetween.net. Récupéré de: differencebetween.net
- Regardez J. (2018). Point d'équivalence: définition et calcul. Récupéré de: study.com
- Whitten, K. W., Davis, R. E., Peck, L. P. et Stanley, G. G. Chemistry. (2008) Huitième édition. Éditeurs d'apprentissage Cengage.


Personne n'a encore commenté ce post.