
Qu'est-ce que la notation spectrale?
La notation spectrale est la disposition des électrons dans les niveaux d'énergie autour du noyau d'un atome. Selon l'ancien modèle atomique de Bohr, les électrons occupent différents niveaux sur les orbites autour du noyau, de la première coquille la plus proche du noyau, K, à la septième coquille, Q, qui est la plus éloignée du noyau..
En termes de modèle de mécanique quantique plus raffiné, les coquilles K-Q sont subdivisées en un ensemble d'orbitales, dont chacune ne peut être occupée par pas plus d'une paire d'électrons..

Communément, la configuration électronique est utilisée pour décrire les orbitales d'un atome dans son état fondamental, mais elle peut également être utilisée pour représenter un atome qui s'est ionisé en un cation ou un anion, compensant la perte ou le gain d'électrons dans leurs orbitales respectives ..
De nombreuses propriétés physiques et chimiques des éléments peuvent être corrélées à leurs configurations électroniques uniques. Les électrons de valence, les électrons de la couche la plus externe, sont le facteur déterminant de la chimie unique de l'élément..
Lorsque les électrons dans la coquille la plus externe d'un atome reçoivent de l'énergie, ils se déplacent vers des couches d'énergie plus élevée. Ainsi, un électron de la couche K sera transféré à la couche L étant dans un état d'énergie plus élevée.
Lorsque l'électron revient à son état fondamental, il libère l'énergie qu'il a absorbée en émettant un spectre électromagnétique (lumière). Étant donné que chaque atome a une configuration électronique spécifique, il aura également un spectre spécifique qui sera appelé spectre d'absorption (ou d'émission)..
Pour cette raison, le terme notation spectrale est utilisé pour désigner la configuration électronique.
Comment déterminer la notation spectrale: les nombres quantiques
Un total de quatre nombres quantiques est utilisé pour décrire complètement le mouvement et les trajectoires de chaque électron dans un atome..
La combinaison de tous les nombres quantiques de tous les électrons d'un atome est décrite par une fonction d'onde qui remplit l'équation de Schrödinger. Chaque électron dans un atome a un ensemble unique de nombres quantiques.
Selon le principe d'exclusion de Pauli, deux électrons ne peuvent pas partager la même combinaison de quatre nombres quantiques.
Les nombres quantiques sont importants car ils peuvent être utilisés pour déterminer la configuration électronique d'un atome et l'emplacement probable des électrons dans l'atome..
Les nombres quantiques sont également utilisés pour déterminer d'autres caractéristiques des atomes, telles que l'énergie d'ionisation et le rayon atomique..
Les nombres quantiques désignent des coquilles, des sous-couches, des orbitales et des spins spécifiques d'électrons.
Cela signifie qu'ils décrivent pleinement les caractéristiques d'un électron dans un atome, c'est-à-dire qu'ils décrivent chaque solution unique à l'équation de Schrödinger, ou la fonction d'onde, des électrons dans un atome..
Il y a un total de quatre nombres quantiques: le nombre quantique principal (n), le nombre quantique de moment angulaire orbital (l), le nombre quantique magnétique (ml) et le nombre quantique de spin électronique (ms).
Le nombre quantique principal, nn, décrit l'énergie d'un électron et la distance la plus probable entre l'électron et le noyau. En d'autres termes, il se réfère à la taille de l'orbitale et au niveau d'énergie auquel un électron est placé..
Le nombre de sous-couches, ou ll, décrit la forme de l'orbitale. Il peut également être utilisé pour déterminer le nombre de nœuds angulaires.
Le nombre quantique magnétique, ml, décrit les niveaux d'énergie dans une sous-couche, et ms se réfère au spin sur l'électron, qui peut être vers le haut ou vers le bas..
Principe d'Aufbau
Aufbau vient du mot allemand "Aufbauen" qui signifie "construire". En substance, en écrivant des configurations électroniques, nous construisons des orbitales d'électrons lorsque nous passons d'un atome à un autre..
Au fur et à mesure que nous écrivons la configuration électronique d'un atome, nous remplirons les orbitales par ordre croissant de numéro atomique.
Le principe Aufbau provient du principe d'exclusion de Pauli qui dit qu'il n'y a pas deux fermions (par exemple des électrons) dans un atome.
Ils peuvent avoir le même ensemble de nombres quantiques, ils doivent donc «s'empiler» à des niveaux d'énergie plus élevés. La façon dont les électrons s'accumulent est une question de configuration électronique.
Les atomes stables ont autant d'électrons que les protons dans le noyau. Les électrons se rassemblent autour du noyau dans des orbitales quantiques en suivant quatre règles de base appelées le principe Aufbau..
- Il n'y a pas deux électrons dans l'atome qui partagent les mêmes quatre nombres quantiques n, l, m et s.
- Les électrons occuperont en premier les orbitales de niveau d'énergie le plus bas.
- Les électrons rempliront toujours les orbitales avec le même nombre de spin. Lorsque les orbitales seront pleines, cela commencera.
- Les électrons rempliront les orbitales de la somme des nombres quantiques n et l. Les orbitales avec des valeurs égales de (n + l) seront remplies en premier avec les n valeurs inférieures.
Les deuxième et quatrième règles sont fondamentalement les mêmes. Un exemple de la règle quatre serait les orbitales 2p et 3s.
Une orbitale 2p est n = 2 et l = 2 et une orbitale 3s est n = 3 et l = 1. (N + l) = 4 dans les deux cas, mais l'orbitale 2p a l'énergie la plus basse ou la valeur n la plus faible et sera remplir avant la couche 3s.
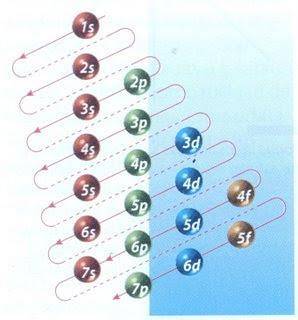
Heureusement, le diagramme de Moeller illustré à la figure 2 peut être utilisé pour effectuer un remplissage électronique. Le graphique est lu en exécutant les diagonales à partir de 1s.
La figure 2 montre les orbitales atomiques et les flèches suivent la voie à suivre.
Maintenant que l'ordre des orbitales est connu pour être rempli, il ne reste plus qu'à mémoriser la taille de chaque orbitale.
Les orbitales S ont 1 valeur possible de ml contenir 2 électrons
Les orbitales P ont 3 valeurs possibles de ml contenir 6 électrons
Les orbitales D ont 5 valeurs possibles de ml contenir 10 électrons
Les orbitales F ont 7 valeurs possibles de ml contenir 14 électrons
C'est tout ce qui est nécessaire pour déterminer la configuration électronique d'un atome stable d'un élément..
Par exemple, prenons l'élément azote. L'azote a sept protons et donc sept électrons. La première orbitale à remplir est l'orbitale 1s. Une orbitale s a deux électrons, il reste donc cinq électrons.
L'orbitale suivante est l'orbite 2s et contient les deux suivantes. Les trois derniers électrons iront à l'orbitale 2p qui peut contenir jusqu'à six électrons.
Règles Hund
La section d'Aufbau a discuté de la façon dont les électrons remplissent d'abord les orbitales d'énergie la plus basse, puis se déplacent vers les orbitales d'énergie la plus élevée seulement après que les orbitales d'énergie la plus basse sont remplies..
Cependant, il y a un problème avec cette règle. Certes, les orbitales 1s doivent être remplies avant les orbitales 2s, car les orbitales 1s ont une valeur inférieure de n, et donc une énergie inférieure..
Et les trois orbitales 2p différentes? Dans quel ordre doivent-ils être remplis? La réponse à cette question implique la règle de Hund.
La règle de Hund stipule que:
- Chaque orbitale d'un sous-niveau est occupée individuellement avant qu'une orbitale ne soit doublement occupée.
- Tous les électrons des orbitales occupées individuellement ont le même spin (pour maximiser le spin total).
Lorsque des électrons sont affectés à des orbitales, un électron cherche d'abord à remplir toutes les orbitales avec une énergie similaire (également appelées orbitales dégénérées) avant de s'associer avec un autre électron dans une orbitale à moitié pleine..
Les atomes dans les états fondamentaux ont tendance à avoir autant d'électrons non appariés que possible. Lors de la visualisation de ce processus, considérez comment les électrons présentent le même comportement que les mêmes pôles dans un aimant s'ils devaient entrer en contact..
Lorsque des électrons chargés négativement remplissent les orbitales, ils essaient d'abord de s'éloigner le plus possible les uns des autres avant de devoir se coupler..
Les références
- Anastasiya Kamenko, T. E. (24 mars 2017). Nombres quantiques. Récupéré de chem.libretexts.org.
- Principe d'Aufbau. (2015, 3 juin). Récupéré de chem.libretexts.org.
- Configurations électroniques et propriétés des atomes. (S.F.). Récupéré de oneonta.edu.
- Encyclopædia Britannica. (2011, 7 septembre). Configuration électronique. Récupéré de britannica.com.
- Helmenstine, T. (7 mars 2017). Le principe Aufbau - Structure électronique et le principe Aufbau. Récupéré de thinkco.com.
- Règles de Hund. (2015, 18 juillet). Récupéré de chem.libretexts.org.
- Notation spectroscopique. (S.F.). Récupéré de bcs.whfreeman.com.


Personne n'a encore commenté ce post.