
Quels sont les éléments diatomiques? (Exemples)
Les éléments diatomiques, Aussi appelées molécules diatomiques homonucléaires, elles ne sont constituées que de deux atomes des mêmes éléments chimiques. Certains éléments ne peuvent exister seuls, même lorsqu'ils sont isolés de tout autre type d'atome.
Les éléments de cette nature se combineront avec des atomes du même élément pour être stables. En d'autres termes, l'hydrogène, un élément diatomique, ne peut pas être par lui-même. Il ne peut pas simplement exister H.
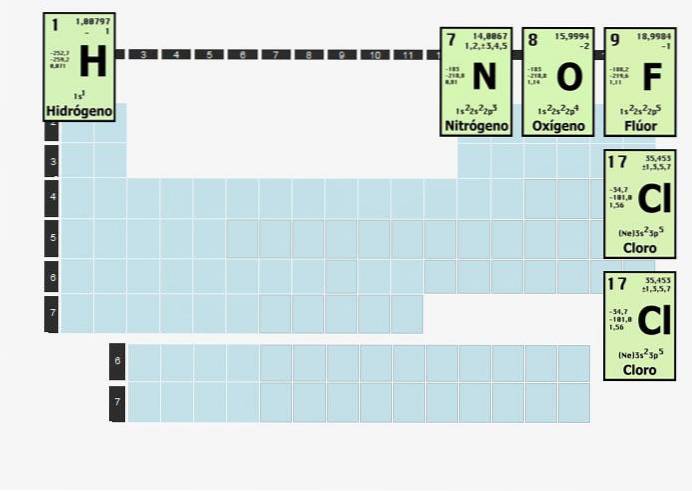
L'hydrogène est si réactif que lorsqu'il est isolé de tout sauf de l'hydrogène, il se combine en une molécule diatomique (à deux atomes). Par conséquent, l'hydrogène gazeux, qui est parfois utilisé comme carburant, existe sous forme de Hdeux.
Molécules diatomiques
Les molécules diatomiques contiennent deux atomes liés chimiquement. Si les deux atomes sont identiques, comme la molécule d'oxygène (Odeux), constitue une molécule diatomique homonucléaire, tandis que si les atomes sont différents, comme dans la molécule de monoxyde de carbone (CO), il forme une molécule diatomique hétéronucléaire.
Les molécules contenant plus de deux atomes sont appelées molécules polyatomiques, par exemple le dioxyde de carbone (COdeux) et de l'eau (HdeuxOU ALORS). Les molécules de polymère peuvent contenir plusieurs milliers d'atomes de composants.
Il y a sept éléments qui composent les molécules diatomiques. Les 5 gaz éléments suivants se trouvent sous forme de molécules diatomiques à température et pression ambiantes:
-Hydrogène - Hdeux
-Azote - Ndeux
-Oxygène - Odeux
-Fluorure - Fdeux
-Chlore - Cldeux
Le brome et l'iode existent couramment sous forme liquide, mais aussi sous forme de gaz diatomiques à des températures légèrement plus élevées, soit un total de 7 éléments diatomiques..
-Brome - Brdeux
-Iode - Ideux
Les éléments diatomiques sont des halogènes (fluor, chlore, brome, iode) et des éléments avec une terminaison -gen (hydrogène, oxygène, azote). L'astatine est un autre halogène, mais son comportement est inconnu..
Propriétés des éléments diatomiques
Toutes les molécules diatomiques sont linéaires, ce qui est l'arrangement spatial le plus simple des atomes.
Il est pratique et courant de représenter une molécule diatomique sous la forme de deux masses ponctuelles (les deux atomes) reliées par un ressort sans masse..
Les énergies impliquées dans les mouvements de la molécule peuvent être divisées en trois catégories:
- Les énergies de traduction (la molécule qui se déplace du point A au point B)
- Énergies rotationnelles (la molécule tournant autour de son axe)
- Énergies vibrationnelles (molécules qui vibrent de différentes manières)
Tous les éléments diatomiques sont des gaz à température ambiante à l'exception du brome et de l'iode qui sont liquides (l'iode peut même être à l'état solide), et tous à l'exception de l'oxygène et de l'azote sont liés par une simple liaison..
La molécule d'oxygène a ses deux atomes reliés par une double liaison et la molécule d'azote par une triple liaison.
Quelques éléments diatomiques
Hydrogène
Hydrogène (Hdeux), avec un numéro atomique de 1, est un gaz incolore qui n'a été officiellement découvert en tant qu'élément par Henry Cavendish qu'en 1766, mais qui a été accidentellement découvert une centaine d'années plus tôt par Robert Boyle.
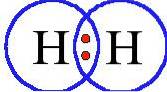
C'est un gaz incolore, inodore et non toxique qui existe naturellement dans notre Univers. Étant le premier élément du tableau périodique, l'hydrogène est le plus léger et le plus abondant de tous les éléments chimiques de l'univers puisqu'il constitue 75% de sa masse..
Azote
Azote (Ndeux) a un numéro atomique de sept et représente environ 78,05% de l'atmosphère terrestre en volume.
C'est un gaz inodore, incolore et principalement inerte, et il reste incolore et inodore à l'état liquide..

Oxygène
Oxygène (Odeux) a un numéro atomique de huit. Ce gaz incolore et inodore a huit protons dans son noyau et est bleu pâle dans ses états liquide et solide..
Un cinquième de l'atmosphère terrestre est composé d'oxygène et c'est le troisième élément le plus abondant de l'univers en masse..
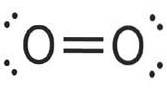
L'oxygène est l'élément en masse le plus abondant dans la biosphère terrestre. La forte concentration d'oxygène dans l'atmosphère est le résultat du cycle de l'oxygène terrestre, qui est principalement entraîné par la photosynthèse des plantes..
Fluor
Fluor (Fdeux) a un numéro atomique de neuf et est le plus réactif et électronégatif de tous les éléments. Cet élément non métallique est un gaz jaune pâle qui fait partie du groupe halogène.
George Gore a apparemment été le premier scientifique à isoler le fluor, mais son expérience a explosé lorsque le fluor produit a réagi avec l'hydrogène..
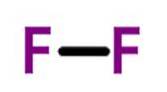
En 1906, Ferdinand Frédéric Henri Moissan reçoit le prix Nobel de chimie pour ses travaux sur l'isolement du fluor en 1886. C'est l'élément le plus électronégatif du tableau périodique..
Chlore
Chlore (Cldeux) est un membre du groupe halogène avec un numéro atomique de dix-sept. L'une de ses formes, NaCl, est utilisée depuis l'Antiquité.

Le chlore est utilisé depuis des milliers d'années sous de nombreuses autres formes, mais il n'a été nommé qu'en 1810 par Sir Humphry Davy..
Le chlore sous sa forme pure est vert jaunâtre, mais ses composés courants sont généralement incolores..
Brome
Brome (Brdeux) a un numéro atomique de trente-cinq. C'est un liquide brun foncé lourd, le seul élément non métallique qui est un liquide.

Le brome a été découvert par Antoine J. Balard en 1826. Il a été utilisé à des fins importantes bien avant sa découverte officielle..
Iode
Iode (jedeux) a un numéro atomique de cinquante-trois, avec cinquante-trois protons dans le noyau d'un atome. C'est un non-métal bleu-noir qui joue un rôle très important dans la chimie organique..
L'iode a été découvert en 1811 par Barnard Courtois. Il l'a nommé iode du mot grec "iodes" qui signifie violet. C'est un solide bleu-noir.
L'iode joue un rôle très important dans la biologie de tous les organismes vivants car sa carence conduit à des maladies telles que l'hyperthyroïdie et l'hypothyroïdie.
Les références
- (S.F.). Molécules diatomiques homonucléaires. Récupéré de boundless.com.
- Faits sur le chlore. (S.F.). Récupéré de softschools.com.
- Éléments diatomiques. (S.F.). Récupéré de ths.talawanda.org.
- Encyclopædia Britannica. (2016, 14 septembre). Molécule. Récupéré de britannica.com.
- Helmenstine, A. (28 septembre 2014). Éléments diatomiques. Récupéré de sciencenotes.org.
- Helmenstine, A. M. (29 mars 2017). Quels sont les sept éléments diatomiques? Récupéré de thinkco.com.
- Faits sur l'oxygène. (S.F.). Récupéré de softschools.com.
- Société royale de chimie. (2015). iode moléculaire. Récupéré de chemspider.com.

Personne n'a encore commenté ce post.