
Réduction (chimie) de quoi il consiste et exemples

La réduction C'est toute cette réaction chimique où les atomes de l'un des réactifs finissent par gagner des électrons; Ce qui peut également être vu de cette façon: votre poste vacant ou "inconfort" électronique est réduit. Un atome gagne des électrons lorsqu'une espèce en fait don; c'est-à-dire qu'il rouille.
Ce type de réaction ne peut pas se produire par lui-même: si une espèce accepte les électrons, une autre doit nécessairement les abandonner. Sinon, la matière serait créée à partir de rien, réduisant les atomes après avoir obtenu des électrons du vide. Par conséquent, il s'agit d'une demi-réaction redox (réduction / oxydation).
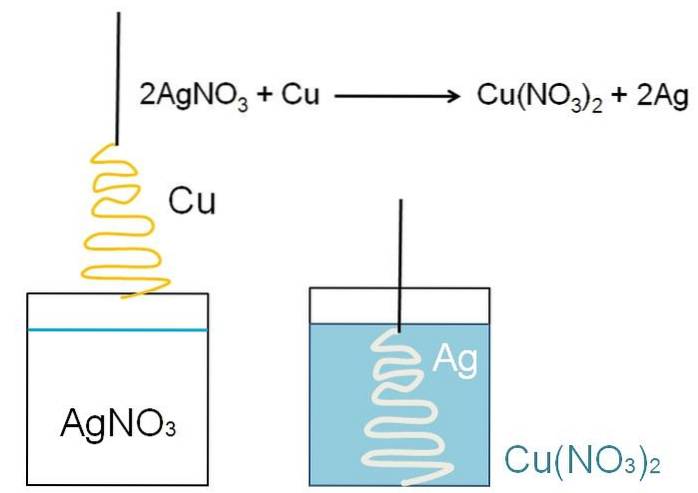
Un exemple illustratif de la réduction qui peut être montrée dans les salles de classe est la réaction entre une surface métallique de cuivre et une solution aqueuse de nitrate d'argent, AgNO3.
En solution, l'argent se trouve sous forme de cations Ag+, chargé positivement. Ceux-ci, en interagissant avec la surface du cuivre, en forme de sapin de Noël, arrachent les électrons aux atomes de cuivre. Lorsque cela se produit, le cuivre remplace l'argent dans le sel de nitrate; et par conséquent, le nitrate de cuivre, Cu (NO3)deux.
Cations de cuivredeux+ à côté de NON3- rendre la solution bleuâtre; et de l'argent, blanchit le sapin de Noël comme s'il le recouvrait de neige.
Index des articles
- 1 Quelle est la réduction?
- 1.1 Nombre d'oxygène
- 1.2 Atome électronégatif
- 2 exemples
- 2.1 Réduction de la chimie organique
- 2.2 Extraction de métaux
- 3 Références
Quelle est la réduction?
En réduction, il a déjà été dit qu'une espèce gagne des électrons. Comment cela peut-il être vérifié dans une équation chimique? Par exemple, dans l'équation de la réaction entre Cu et AgNO3, Comment savoir quand la réduction intervient? Pour le vérifier, il est nécessaire de déterminer le nombre ou l'état d'oxydation.
Les éléments à leur état naturel, ont par définition un état d'oxydation égal à zéro, car on suppose qu'ils n'ont ni perdu ni gagné d'électrons. Ainsi, les métaux solides ont un état d'oxydation nul. Ainsi, l'argent passe de +1 (Ag+) à 0 (Ag). La charge d'un ion métallique est égale à son état d'oxydation.
Par contre, les électrons provenaient du cuivre: passant de 0 (Cu) à +2 (Cudeux+). Anion nitrate, NON3- reste inchangé pendant que les deux métaux échangent des électrons; par conséquent, l'équation peut s'écrire:
2Ag+ + Cu => 2Ag + Cudeux+
Notez que les charges et les atomes sont équilibrés..
C'est en quoi consiste la réduction chimique: dans le gain d'électrons qui rendent les états d'oxydation des atomes moins positifs que celui des électrons..
Numéro d'oxygène
Les oxygènes sont des atomes très électronégatifs et oxydants, donc lorsqu'un atome forme des composés avec eux (comme des oxydes), ils ont des états d'oxydation positifs. Plus le nombre d'oxygène interagissant avec l'atome est grand, plus son état d'oxydation sera positif; ou qu'est-ce que c'est pareil, c'est plus rouillé.
Par conséquent, lorsqu'un composé a moins d'atomes d'oxygène, on dit qu'il est moins oxydé; c'est-à-dire que l'atome perd moins d'électrons.
Un exemple classique peut être vu dans le monoxyde de carbone et le dioxyde de carbone. Pour le CO, le carbone a un état d'oxydation de +2; tandis que pour le COdeux, son état d'oxydation est +4.
Donc, si dans une réaction le COdeux il se transforme en CO, on dit qu'une réduction se produit; depuis, le carbone interagit désormais avec un oxygène et non deux. Pour la réaction inverse, le CO se transforme en COdeux, on parle d'une oxydation du carbone.
Ceci s'applique à tous les atomes, en particulier aux métaux dans leurs oxydes métalliques; par exemple, CrOdeux (Cr4+) et CrO3 (Cr6+).
Dans les équations chimiques où une espèce perd de l'oxygène tandis que l'autre en gagne, un transfert d'oxygène se produit..
Atome électronégatif
Vous pouvez toujours déterminer s'il y a eu une réduction en modifiant l'état d'oxydation à une valeur moins positive. Comme je viens de l'expliquer, un moyen rapide de remarquer sans même faire le calcul consiste à observer s'il y a une diminution des atomes d'oxygène dans un composé..
La même chose peut arriver avec tout autre atome qui est plus électronégatif que l'atome qui gagne ou perd des électrons.
Par exemple, si les FC4 réagit de telle manière qu'il devient CH4, on dit alors qu'une réduction s'est produite; puisque le fluor est beaucoup plus électronégatif que l'atome d'hydrogène. En conséquence, le carbone est moins oxydé dans le CH4 que dans les FC4, ce qui équivaut à dire qu'il a été réduit.
Exemples
Réduction de la chimie organique
L'exemple CF4 et CH4 il reflète ce qui se passe dans les réactions organiques, où la réduction de la charge partielle d'un atome est considérée comme un gain électronique. Cela s'applique beaucoup lorsque l'on considère la réduction des groupes fonctionnels oxygénés..
Par exemple, considérons les groupes ROH, RCHO et COOH. Le premier correspond aux alcools, où le carbone se lie à l'oxygène (C-OH); le second est le groupe aldéhyde, où le carbone forme une double liaison avec l'oxygène et est également lié à l'hydrogène (C = O-H); et le troisième est le groupe carboxyle.
Dans le groupe carboxyle, le carbone forme une double liaison avec un O et une simple liaison avec un autre O (HO-C = O).
Par conséquent, une réduction se produit si un acide carboxylique est transformé en alcool:
RCOOH => ROH
Extraction de métaux
La réduction chimique est extrêmement importante dans les processus d'extraction des métaux de leurs minéraux. Certaines des réactions sont:
HgS + Odeux => Hg + SOdeux
Le sulfure de mercure est réduit en mercure métallique.
CudeuxS + Odeux => 2Cu + SOdeux
Le sulfure de cuivre est réduit en cuivre métallique.
2ZnS + 3Odeux => 2ZnO + 2SOdeux
ZnO + C => Zn + CO (notez le transfert de O)
Le sulfure de zinc est d'abord réduit à son monoxyde puis à sa forme métallique.
FoideuxOU ALORS3 + 3CO => 2Fe + 3COdeux
L'oxyde ferrique est réduit en fer métallique.
WO3 + 3Hdeux => W + 3HdeuxOU ALORS
Et le trioxyde de tungstène est réduit en tungstène métallique.
À titre d'exercice, l'indice d'oxydation du métal peut être déterminé avant qu'il ne soit réduit.
Les références
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE.
- Chimie LibreTexts. (9 décembre 2018). Réactions d'oxydoréduction. Récupéré de: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (04 juillet 2018). La définition de la réduction en chimie. Récupéré de: thinkco.com
- Hultzman R. (2019). Réduction en chimie: définition et aperçu. Étude. Récupéré de: study.com
- Clark J. (2013). Définitions de l'oxydation et de la réduction (redox). Récupéré de: chemguide.co.uk
- Vue du tuteur. (s.f.). Réaction de réduction. Récupéré de: chemistry.tutorvista.com


Personne n'a encore commenté ce post.