
Formule générale, nomenclature et exemples des sels binaires
le sels binaires sont des espèces ioniques largement connues en chimie, identifiées comme des substances faisant partie d'électrolytes forts, en raison de leur dissociation complète en leurs ions constitutifs lorsqu'ils sont en solution.
Le terme «binaire» désigne leur formation, car ils ne sont composés que de deux éléments: un cation d'origine métallique avec un anion simple d'origine non métallique (autre que l'oxygène), qui sont liés par une liaison ionique..
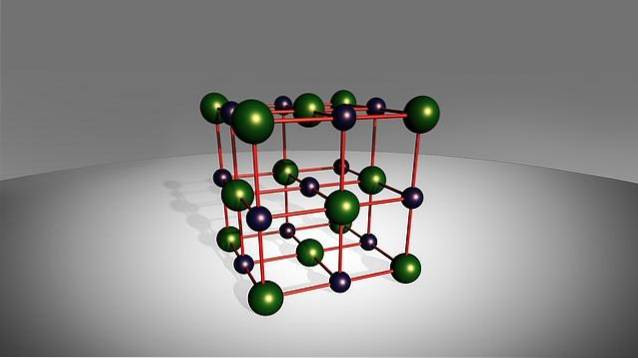
Bien que leur nom indique qu'ils ne sont formés que de deux éléments, cela n'empêche pas que dans certains de ces sels, il puisse y avoir plus d'un atome du métal, du non-métal ou des deux espèces. En revanche, certaines de ces espèces présentent un comportement assez toxique, comme le fluorure de sodium, le NaF.
Ils peuvent également montrer une réactivité élevée au contact de l'eau, bien qu'entre des sels chimiquement très similaires, ces propriétés puissent varier énormément..
Index des articles
- 1 Formule générale des sels binaires
- 2 Nomenclature des sels binaires
- 2.1 Nomenclature systématique
- 2.2 Nomenclature des stocks
- 2.3 Nomenclature traditionnelle
- 3 Comment se forment les sels binaires?
- 4 Exemples de sels binaires
- 5 Références
Formule générale des sels binaires
Comme indiqué précédemment, les sels binaires sont constitués d'un métal et d'un non-métal dans leur structure, de sorte que leur formule générale est MmXn (où M est l'élément métallique et X l'élément non métallique).
De cette manière, les métaux qui font partie des sels binaires peuvent provenir du bloc «s» du tableau périodique - alcalins (comme le sodium) et alcalino-terreux (comme le calcium) - ou du bloc «p» du tableau périodique (comme l'aluminium).
De même, parmi les éléments non métalliques qui constituent ce type de substances chimiques figurent ceux du groupe 17 du tableau périodique, appelés halogènes (comme le chlore), ainsi que d’autres éléments du bloc «p» tels que soufre ou azote, à l'exception de l'oxygène.
Nomenclature des sels binaires
Selon l'Union internationale de chimie pure et appliquée (UICPA), trois systèmes peuvent être utilisés pour nommer les sels binaires: la nomenclature systématique, la nomenclature des stocks et la nomenclature traditionnelle.
Nomenclature systématique
Lorsque vous utilisez cette méthode, vous devez commencer par le nom du non-métal, en ajoutant la terminaison -uro; par exemple, dans le cas d'un sel de brome (Br), il serait nommé "bromure".
Immédiatement après avoir nommé le non-métal, la préposition «de» est placée; dans le cas précédent, ce serait "bromure de".
Enfin, l'élément métallique est nommé comme on l'appelle normalement. Par conséquent, si le même exemple est suivi et qu'il est composé de potassium comme métal, le composé s'écrirait KBr (dont la structure est correctement équilibrée) et est appelé bromure de potassium..
Dans le cas où la stoechiométrie du sel diffère de la combinaison 1: 1, chaque élément est nommé en utilisant un préfixe qui indique l'indice ou le nombre de fois que chacun est trouvé.
Par exemple, le rapport de combinaison dans le sel de CaCldeux il est de 1: 2 (pour chaque atome de calcium, il y a deux chlore), il est donc appelé dichlorure de calcium; se produit de la même manière avec les autres composés.
Nomenclature des stocks
Lorsque vous utilisez cette procédure, vous commencez par nommer le composé d'une manière très similaire à la façon dont cela est fait dans la nomenclature systématique, mais sans préfixer aucun composant de la substance..
Dans ce cas, seul le nombre d'oxydation de l'élément métallique est pris en compte (sa valeur absolue dans tous les cas).
Pour nommer le sel binaire, placez le numéro de valence en notation romaine entre parenthèses, après le nom de l'espèce. FeCl peut être donné à titre d'exempledeux qui, selon ces règles, est appelé chlorure de fer (II).
Nomenclature traditionnelle
Lorsque les normes de la nomenclature traditionnelle sont suivies, au lieu d'ajouter un préfixe à l'anion ou au cation du sel ou de placer explicitement le numéro de valence du métal, un suffixe est plutôt placé en fonction de l'état d'oxydation du métal.
Pour utiliser cette méthode, le non-métal est nommé de la même manière que dans la méthode stock et, si un sel est présent dont les éléments ont plus d'un numéro d'oxydation, il doit être nommé en utilisant un suffixe qui l'indique..
Dans le cas où l'élément métallique utilise son indice d'oxydation le plus bas, le suffixe «ours» est ajouté; En revanche, si vous utilisez son numéro de valence le plus élevé, le suffixe "ico" est ajouté..
Un exemple de ceci peut être le composé FeCl3, qui est appelé «chlorure ferrique» parce que le fer utilise sa valence maximale (3). Dans le sel FeCldeux, dans lequel le fer utilise sa valence la plus basse (2), le nom de chlorure ferreux est utilisé. Cela se passe de la même manière avec le reste.
Comment se forment les sels binaires?
Comme mentionné précédemment, ces substances de nature majoritairement neutre sont formées par la combinaison au moyen d'une liaison ionique d'un élément métallique (comme ceux du groupe 1 du tableau périodique) et d'une espèce non métallique (comme celles du groupe 17 de le tableau périodique), sauf pour les atomes d'oxygène ou d'hydrogène.
De la même manière, il est courant de constater que dans les réactions chimiques impliquant des sels binaires, il y a un dégagement de chaleur, ce qui signifie qu'il s'agit d'une réaction exothermique. De plus, il existe différents risques selon le sel avec lequel il est traité.
Exemples de sels binaires
Voici quelques sels binaires avec leurs différents noms, selon la nomenclature utilisée:
NaCl
- Chlorure de sodium (nomenclature traditionnelle)
- Chlorure de sodium (nomenclature stock)
- Monochlorure de sodium (nomenclature systématique)
BaCldeux
- Chlorure de baryum (nomenclature traditionnelle)
- Chlorure de baryum (nomenclature de stock)
- Dichlorure de baryum (nomenclature systématique)
CoS
- Sulfure de cobalt (nomenclature radicale)
- Sulfure de cobalt (II) (nomenclature de base)
- Monosulfure de cobalt (nomenclature systématique)
CodeuxS3
- Sulfure de cobalt (nomenclature traditionnelle)
- Sulfure de cobalt (III) (nomenclature de base)
- Trisulfure de dicobalt (nomenclature systématique)
Les références
- Wikipédia. (s.f.). Phase binaire. Récupéré de en.wikipedia.org
- Chang, R. (2007). Chimie, neuvième édition (McGraw-Hill).
- Levy, J. M. (2002). Hazmat Chemistry Study Guide, deuxième édition. Récupéré de books.google.co.ve
- Burke, R. (2013). Chimie des matières dangereuses pour les intervenants d'urgence, troisième édition. Récupéré de books.google.co.ve
- Franzosini, P. et Sanesi, M. (2013). Propriétés thermodynamiques et de transport des sels organiques. Récupéré de books.google.co.ve


Personne n'a encore commenté ce post.