
Propriétés des sels organiques, utilisations et exemples

le sels organiques il s'agit d'un nombre dense de composés ioniques aux caractéristiques innombrables. Ils sont préalablement dérivés d'un composé organique, qui a subi une transformation qui lui permet de porter une charge, et aussi, son identité chimique dépend de l'ion associé.
Deux formules chimiques très générales pour les sels organiques sont présentées dans l'image ci-dessous. Le premier, R-AX, est interprété comme un composé dans la structure carbonée duquel un atome, ou groupe A, porte une charge positive + ou négative (-).
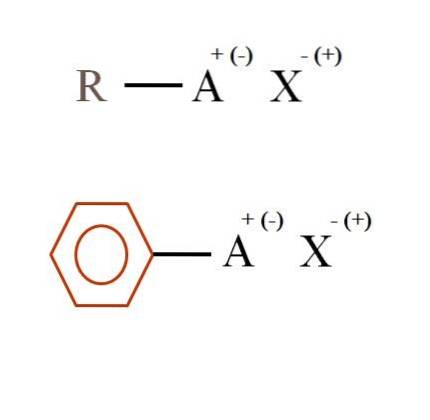
Comme on peut le voir, il existe une liaison covalente entre R et A, RA, mais à son tour, A a une charge formelle qui attire (ou repousse) l'ion X. Le signe de la charge dépendra de la nature de A et du environnement chimique.
Si A était positif, avec combien de X pourrait-il interagir? Avec un seul, étant donné le principe de l'électroneutralité (+ 1-1 = 0). Cependant, quelle est l'identité de X? Anion X pourrait être CO3deux-, nécessitant deux cations RA+; un halogénure: F-, Cl-, Br-, etc.; ou même un autre composé RA-. Les options sont incalculables.
De plus, un sel organique peut avoir un caractère aromatique, illustré par le cycle benzénique brun. Le sel benzoate de cuivre (II), (C6H5ROUCOULER)deuxCu, par exemple, se compose de deux cycles aromatiques avec des groupes carboxyle chargés négativement, qui interagissent avec le cation Cu.deux+.
Index des articles
- 1 Propriétés physiques et chimiques
- 1.1 Masses moléculaires élevées
- 1.2 Amphiphiles et tensioactifs
- 1.3 Points d'ébullition ou de fusion élevés
- 1.4 Acidité et basicité
- 2 utilisations
- 3 Exemples de sels organiques
- 3.1 Carboxylates
- 3.2 Diakylcuprates de lithium
- 3.3 Sels de sulfonium
- 3.4 Sels d'oxonium
- 3.5 Sels d'amine
- 3.6 Sels de diazonium
- 4 Références
Proprietes physiques et chimiques
D'après l'image, on peut dire que les sels organiques se composent de trois composants: l'organique, R ou Ar (le cycle aromatique), un atome ou un groupe qui porte la charge ionique A et un contre-ion X.
Tout comme l'identité et la structure chimique sont définies par de tels composants, de la même manière leurs propriétés en dépendent..
De ce fait, certaines propriétés générales que remplissent la grande majorité de ces sels peuvent être résumées..
Masses moléculaires élevées
En supposant des anions X inorganiques mono ou polyvalents, les sels organiques ont tendance à avoir des masses moléculaires beaucoup plus grandes que les sels inorganiques. Cela est principalement dû au squelette carboné, dont les liaisons simples C-C et leurs atomes d'hydrogène, contribuent beaucoup à la masse du composé..
Par conséquent, R ou Ar sont responsables de leurs masses moléculaires élevées..
Amphiphiles et tensioactifs
Les sels organiques sont des composés amphiphiles, c'est-à-dire que leurs structures ont des extrémités à la fois hydrophiles et hydrophobes..
Quels sont ces extrêmes? R ou Ar représentent l'extrême hydrophobe, car leurs atomes C et H n'ont pas une grande affinité pour les molécules d'eau.
À+(-), l'atome ou le groupe porteur de charge est l'extrémité hydrophile, car il contribue au moment dipolaire et interagit avec l'eau, formant des dipôles (RA+ Ohdeux).
Lorsque les régions hydrophiles et hydrophobes sont polarisées, le sel amphiphile devient un tensioactif, une substance largement utilisée pour la fabrication de détergents et désémulsifiants.
Points d'ébullition ou de fusion élevés
Comme les sels inorganiques, les sels organiques ont également des points de fusion et d'ébullition élevés, en raison des forces électrostatiques qui régissent la phase liquide ou solide..
Cependant, comme il existe un composant organique R ou Ar, d'autres types de forces de Van der Waals participent (forces de Londres, dipôle-dipôle, liaisons hydrogène) qui rivalisent d'une certaine manière avec l'électrostatique..
Pour cette raison, les structures solides ou liquides des sels organiques sont, dans un premier temps, plus complexes et variées. Certains d'entre eux peuvent même se comporter comme cristaux liquides.
Acidité et basicité
Les sels organiques sont généralement des acides ou des bases plus forts que les sels inorganiques. En effet, A, par exemple dans les sels d'amine, a une charge positive en raison de sa liaison avec un hydrogène supplémentaire: A+-H. Puis, au contact d'une base, donnez le proton pour redevenir un composé neutre:
RA+H + B => RA + HB
Le H appartient à A, mais il s'écrit car il participe à la réaction de neutralisation.
D'autre part, RA+ Il peut s'agir d'une grosse molécule, incapable de former des solides avec un réseau cristallin suffisamment stable avec l'anion hydroxyle ou hydroxyle OH-.
Quand c'est le cas, le sel RA+Oh- se comporte comme une base solide; même aussi basique que NaOH ou KOH:
RA+Oh- + HCl => RACl + HdeuxOU ALORS
Notez dans l'équation chimique que l'anion Cl- remplace OH-, formant le sel RA+Cl-.
Applications
L'utilisation de sels organiques variera en fonction de l'identité de R, Ar, A et X. De plus, leur application dépend également du type de solide ou de liquide qu'ils forment. Quelques généralités à cet égard sont:
-Ils servent de réactifs pour la synthèse d'autres composés organiques. RAX peut agir en tant que «donneur» pour la chaîne R à ajouter à un autre composé remplaçant un bon groupe partant.
-Ce sont des tensioactifs, ils peuvent donc également être utilisés comme lubrifiants. Des sels métalliques de carboxylates sont utilisés à cet effet.
-Ils permettent de synthétiser une large gamme de colorants.
Exemples de sels organiques
Carboxylates
Les acides carboxyliques réagissent avec un hydroxyde dans une réaction de neutralisation, donnant naissance à des sels carboxylates: RCOO- M+; où M+ peut être n'importe quel cation métallique (Na+, Pbdeux+, K+, etc.) ou le cation ammonium NH4+.
Les acides gras sont des acides carboxyliques à longue chaîne aliphatique, ils peuvent être saturés et insaturés. Parmi les saturés se trouvent l'acide palmitique (CH3(CHdeux)14COOH). Cela est à l'origine du sel de palmitate, tandis que l'acide stéarique (CH3(CHdeux)16COOH forme le sel stéarate. Les savons sont constitués de ces sels.
Pour le cas de l'acide benzoïque, C6H5COOH (où C6H5- est un cycle benzénique), lorsqu'il réagit avec une base, il forme des sels de benzoate. Dans tous les carboxylates, le groupe -COO- représente A (RAX).
Diakylcuprates de lithium
Le diakylcuprate de lithium est utile en synthèse organique. Sa formule est [R-Cu-R]-Li+, dans lequel l'atome de cuivre porte une charge négative. Ici, le cuivre représente l'atome A dans l'image.
Sels de sulfonium
Ils sont formés à partir de la réaction d'un sulfure organique avec un halogénure d'alkyle:
RdeuxS + R'X => RdeuxR'S+X
Pour ces sels, l'atome de soufre porte une charge formelle positive (S+) en ayant trois liaisons covalentes.
Sels d'oxonium
De même, les éthers (les analogues oxygénés des sulfures) réagissent avec les hydracides pour former des sels d'oxonium:
ROR '+ HBr <=> RO+HR '+ Br-
Le proton acide de HBr est lié de manière covalente à l'atome d'oxygène de l'éther (RdeuxOU ALORS+-H), en le chargeant positivement.
Sels d'amine
Les amines peuvent être primaires, secondaires, tertiaires ou quaternaires, comme leurs sels. Tous sont caractérisés par un atome H lié à l'atome d'azote.
Ainsi, RNH3+X- est un sel d'amine primaire; RdeuxNHdeux+X-, amine secondaire; R3NH+X-, amine tertiaire; et R4N+X-, amine quaternaire (sel d'ammonium quaternaire).
Sels de diazonium
Enfin, les sels de diazonium (RNdeux+X-) ou aryldiazonium (ArNdeux+X-), représentent le point de départ de nombreux composés organiques, en particulier les colorants azoïques.
Les références
- Francis A. Carey. Chimie organique. (Sixième éd., Pages 604-605, 697-698, 924). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. Chimie organique. Amines. (10e édition.). Wiley plus.
- Wikipédia. (2018). Sel (chimie). Tiré de: en.wikipedia.org
- Steven A. Hardinger. (2017). Glossaire illustré de chimie organique: sels. Récupéré de: chem.ucla.edu
- Chevron Oronite. (2011). Carboxylates. [PDF]. Récupéré de: oronite.com



Personne n'a encore commenté ce post.