
Réaction de saponification et substances pouvant être obtenues

La saponification est l'hydrolyse basique d'un ester. Cela signifie que l'ester réagit de manière irréversible avec une base (NaOH ou KOH), produisant de l'alcool et des carboxylates de sodium ou de potassium. Le mot signifie «fabrication de savon» et, en fait, c'est l'une des réactions chimiques les plus anciennes utilisées par l'humanité..
À l'époque babylonienne, à l'aide des cendres récoltées sur le bois, les plantes et les graisses animales, ils perfectionnèrent l'art de la fabrication du savon. Pourquoi la graisse animale? La raison en est qu'elle est riche en triesters de glycérol (triglycérides) et que la cendre de bois est une source de potassium, le métal de base.
Sinon, la réaction se poursuit avec un rendement inférieur, mais suffisant pour refléter ses effets sur les peintures et certaines surfaces. C'est le cas des peintures à l'huile, où les pigments sont mélangés à de l'huile (source d'esters).
Index des articles
- 1 réaction de saponification
- 1.1 Mécanisme
- 1.2 Cinétique
- 2 Substances pouvant être obtenues par saponification
- 2.1 Action dissolvante des savons
- 3 Références
Réaction de saponification
Mécanisme
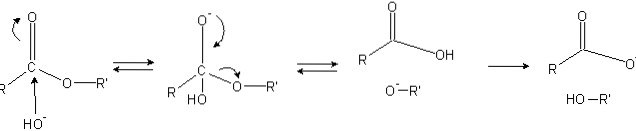
Les esters ont un groupe acyle (O = C-R), qui est sensible aux attaques nucléophiles telles que OH-.
Parce que les atomes d'oxygène «volent» la densité électronique de l'atome de carbone, il est partiellement chargé positivement, encore plus dans le cas des esters.
Par conséquent, cette charge positive attire des espèces négatives capables de fournir des électrons à l'atome de carbone, provoquant une attaque nucléophile (côté gauche de l'image). En conséquence, un intermédiaire tétraédrique est formé (la deuxième molécule de gauche à droite).
La charge négative sur l'oxygène de l'intermédiaire tétraédrique est le produit d'un OH- alentours. Cette charge négative est ensuite délocalisée pour donner naissance au groupe carbonyle, puis "forçant" la liaison C-OR 'à se rompre. De même, cette délocalisation produit un acide carboxylique RCOOH et un ion alcoxyde R'O-.
Enfin, le milieu réactionnel étant basique, l'alcoxyde déprotonate une molécule d'eau et l'acide carboxylique réagit avec un autre OH.- le milieu, générant les produits de saponification.
Cinétique
La vitesse de la réaction de saponification est proportionnelle aux concentrations des réactifs. En d'autres termes, en augmentant la concentration de l'ester (RCOOR ') ou de la base (NaOH), la réaction se déroulera plus rapidement.
Cela se traduit également comme suit: la vitesse de saponification est de premier ordre par rapport à l'ester, et de premier ordre par rapport à la base. Ce qui précède peut être exprimé avec l'équation mathématique suivante:
Vitesse = k [RCOOR '] [NaOH]
Où k est la constante ou le coefficient de vitesse, qui varie en fonction de la température ou de la pression; c'est-à-dire que plus la chaleur est élevée, plus le taux de saponification est élevé. Pour cette raison, le milieu est bouilli.
Puisque les deux réactifs sont du premier ordre cinétique, la réaction globale est du second ordre.
Dans le mécanisme de réaction de saponification, la formation de l'intermédiaire tétraédrique nécessite une attaque nucléophile, qui implique à la fois l'ester et la base..
Ainsi, la cinétique du second ordre se reflète dans ce fait, car elle intervient dans l'étape déterminante (lente) de la réaction.
Substances pouvant être obtenues par saponification

Les principaux produits de la saponification sont les alcools et les sels d'acides carboxyliques. En milieu acide, les RCOOH respectifs sont obtenus, obtenus par saponification de graisses et d'huiles, appelées acides gras.
Ainsi, les savons sont constitués de sels d'acides gras produits par saponification. Sortez-vous avec quels cations? Ils peuvent être Na+, K+, Mgdeux+, Foi3+, etc.
Ces sels sont solubles dans l'eau, mais sont précipités par l'action du NaCl ajouté au mélange, ce qui déshydrate le savon et le sépare de la phase aqueuse. La réaction de saponification d'un triglycéride est la suivante:
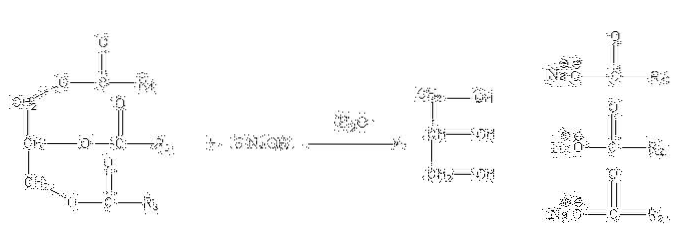
La glycérine est le "E" alcoolique, et le savon est tous les sels des acides gras résultants. Ici, chaque chaîne latérale -R a des longueurs et un degré d'insaturation différents. Par conséquent, ces chaînes font la différence entre les graisses végétales et les huiles.
La clé de la fabrication des savons réside alors dans la sélection des meilleures graisses et huiles, ou plus précisément, dans la sélection des différentes sources de triglycérides..
Cette masse blanche savonneuse peut contenir des colorants et d'autres composés organiques dans sa structure, lui donnant des arômes agréables et des couleurs vives. De là, l'éventail des possibilités est apprivoisé par l'art et la vocation de ce métier..
Cependant, la réaction de saponification est également une voie de synthèse d'acides carboxyliques et d'alcools qui n'ont pas nécessairement à voir avec la glycérine ou les savons..
Par exemple, l'hydrolyse basique de tout ester, tel que l'acétate d'éthyle simple, produira de l'acide acétique et de l'éthanol..
Action dissolvante des savons

Les sels d'acides gras sont solubles dans l'eau, mais pas de la même manière que les ions sont solvatés; c'est-à-dire entouré d'une sphère aqueuse. Dans le cas des savons, leurs chaînes latérales -R les empêchent théoriquement de se dissoudre dans l'eau.
Par conséquent, pour contrer cette position énergétiquement maladroite, elles sont orientées de telle manière que ces chaînes entrent en contact, formant un noyau organique apolaire, tandis que les têtes polaires, l'extrême (-COO- N / A+), interagissent avec les molécules d'eau et créent une "coquille polaire".
Ce qui précède est illustré dans l'image du haut, où ce type de structure connue sous le nom de micelle est montré.
Les "queues noires" correspondent aux chaînes hydrophobes, s'emmêlant dans un noyau organique protégé par les sphères grises. Ces sphères grises composent la cuirasse polaire, les têtes -COO- N / A+.
Ainsi, les micelles sont des grappes (agglomérations) de sels d'acides gras. À l'intérieur de ceux-ci, ils peuvent contenir de la graisse, qui est insoluble dans l'eau en raison de son caractère non polaire..
Comme ils le font? Les chaînes grasses et -R sont toutes deux hydrophobes, donc les deux ont une forte affinité l'une pour l'autre.
Lorsque les micelles renferment les graisses, l'eau interagit avec la coquille polaire, permettant la solubilité du savon. De même, les micelles sont chargées négativement, provoquant des répulsions entre elles et, par conséquent, générant la dispersion de graisse..
Les références
- Anne Marie Helmenstine, Ph.D. (03 octobre 2017). Définition et réaction de la saponification. Récupéré le 24 avril 2018 de: thinkco.com
- Francis A. Carey. Chimie organique. Acides carboxyliques. (sixième éd., pages 863-866). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. Chimie organique. Lipids (10e édition., Pages 1056-1058). Wiley plus.
- Wikipédia. (2018). Saponification. Extrait le 24 avril 2018 de: en.wikipedia.org
- Boyd C. (27 février 2015). Comprenez la chimie et l'histoire du savon. Extrait le 24 avril 2018 de: chemservice.com
- Luca Laghi. (27 mars 2007). Saponification. Extrait le 24 avril 2018 de: commons.wikimedia.org
- Amanda Crochet. (12 mai 2015). Micelle (niveaux de gris). Extrait le 24 avril 2018 de: commons.wikimedia.org



Personne n'a encore commenté ce post.