
Série spectrale
le série spectrale Ils sont constitués d'un ensemble de lignes colorées sur fond sombre ou de bandes lumineuses séparées par des zones sombres qui émettent de la lumière provenant de toutes sortes de substances..
Ces lignes sont visualisées à l'aide d'un spectromètre, appareil constitué d'un prisme ou d'un réseau finement divisé, capable de séparer les différentes composantes de la lumière..
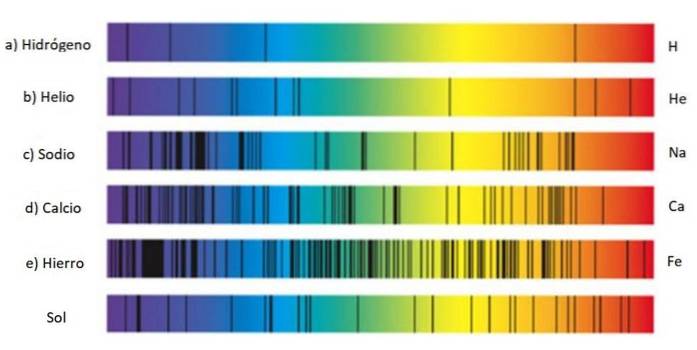
Ces ensembles de lignes sont appelés spectre et chaque substance a un spectre caractéristique, une sorte d'empreinte digitale qui sert à identifier sa présence dans la lumière provenant d'un objet. C'est parce que chaque atome a sa propre configuration électronique et des niveaux d'énergie autorisés..
C'est pourquoi la recherche de raies spectrales est une technique largement utilisée par les astronomes pour connaître la composition des étoiles grâce à la lumière qu'elles émettent. En fait, tout ce que les astronomes savent sur les étoiles vient de leur spectre, qu'il s'agisse d'émission ou d'absorption..
L'origine des spectres
La présence des spectres est due à la configuration atomique. En effet, les électrons sont maintenus autour du noyau dans des régions appelées orbitales, situé à des distances discrètes de lui.
Par exemple dans l'hydrogène, l'élément le plus simple, les rayons orbitaux sont donnés par 0,053 ∙ ndeux nanomètres, où n = 1, 2, 3, 4,…. Les valeurs intermédiaires entre celles-ci ne sont pas autorisées, c'est pourquoi on dit que les orbitales sont quantifié. L'état énergétique de chaque orbitale est également quantifié.
De telles restrictions font que les électrons se comportent à la fois comme des particules et aussi comme des ondes, tout comme la lumière. Cependant, les électrons peuvent passer d'une orbitale à une autre, modifiant l'état énergétique de l'atome..
Absorption et émission d'énergie électromagnétique
Par exemple, si un électron passe d'une orbitale plus interne, avec une énergie plus faible, à une orbitale plus externe et énergétique, il est nécessaire qu'il acquière l'énergie électromagnétique nécessaire, qui est stockée dans l'atome. Ce processus s'appelle absorption.
En revanche, si l'électron passe d'une orbitale externe à une orbitale plus interne, un photon est émis dans la transition, sous forme de lumière, qui est l'énergie correspondant à la différence d'énergie entre les orbitales. La longueur d'onde correspond à cette différence et est donnée par:

- E est l'énergie
- λ est la longueur d'onde
- h est la constante de Planck
- c est la vitesse de la lumière
Types de spectres
Des spectres d'absorption et d'émission sont produits, qui dépendent de certains paramètres de l'objet ou de la substance, tels que la densité et la température. Le spectre d'un gaz mince est différent de celui d'un solide à haute température.
Spectre continu
Certaines sources émettent des spectres dont les lignes colorées changent en douceur et contiennent toutes les couleurs. C'est ce qu'on appelle un spectre continu, par exemple celui produit par le filament d'une ampoule à incandescence.
Spectre d'émission
C'est celui que certaines substances chaudes émettent et se compose de quelques lignes d'une certaine longueur d'onde.
Ce type de spectre est produit par des gaz chauds et minces comme ceux qui remplissent les tubes fluorescents. L'aurore boréale est un autre exemple d'émission qui se produit dans les gaz de la haute atmosphère terrestre. Certains nuages de gaz interstellaires produisent également des spectres d'émission..
Spectre d'absorption
Ce spectre est ce qui est reçu lorsque la lumière d'un objet très chaud et dense traverse un gaz plus froid. Dans celui-ci, presque toutes les couleurs sont observées, mais certaines semblent diminuées et des franges sombres apparaissent dans les longueurs d'onde absorbées par les atomes ou les molécules du gaz..
Lois de la spectroscopie de Kirchoff
Les lois de la spectroscopie de Kirchoff indiquent dans quelles conditions les différents spectres décrits ci-dessus sont formés:
- Spectres continus: ils sont émis par n'importe quel objet à haute pression et température.
- Spectres d'émission: sont produits par un gaz chaud à basse pression, qui émet des raies dans des longueurs d'onde bien définies, correspondant aux transitions électroniques correspondant à chaque élément constituant le gaz.
- Spectres d'absorption: sont produits par des gaz à basse température situés à proximité de sources de rayonnement continu. Les atomes ou molécules de gaz n'absorbent que certaines longueurs d'onde.
Le spectre d'émission de l'hydrogène
Le spectre d'émission de l'hydrogène est particulièrement important, car c'est l'élément le plus abondant de tout l'univers et contient de nombreuses informations importantes sur les étoiles et la Voie lactée..
Les séries de raies du spectre de l'hydrogène ont été découvertes par divers chercheurs et chacune porte son nom.
Série Balmer
L'hydrogène émet plusieurs raies dans le spectre visible: lorsque l'électron se désintègre de l'orbitale 3 à l'orbitale 2, il émet une lumière rouge, dont la longueur d'onde est de 656,6 nm, et s'il se désintègre de l'orbite 4 à l'orbite 2, il émet une lumière bleue de 486,1 nm.

En 1885 (avant que Bohr ne propose sa théorie), le mathématicien et professeur suisse Johann Balmer (1825-1898) trouva par essais et erreurs une formule pour déterminer les longueurs d'onde λ de ces raies:

Où:
- R est la constante de Rydberg: 1,097 × 107 m-1
- n = 3, 4, 5…., c'est-à-dire n ≥ 3 (entier).
Par exemple, pour n = 3 dans l'équation de Balmer:

Correspondant à la ligne rouge à droite, illustrée dans la figure ci-dessus. La découverte de la série Balmer a conduit d'autres scientifiques à rechercher des lignes dans le reste du spectre pour l'hydrogène et d'autres gaz..
Série Lyman
Notez que le spectre de l'hydrogène représenté sur la figure contient des raies ultraviolettes, les deux à l'extrême gauche, dont les longueurs d'onde sont de 397,0 nm et 388,9 nm. nm.
En effet, ces lignes ultraviolettes correspondent à la série dite de Lyman, découverte en 1906 par le physicien Théodore Lyman. Sa formule est:

Série Paschen
La série Paschen a été découverte par le physicien allemand Friederich Paschen en 1908 et est valable pour n ≥ 4, soit: n = 4, 5, 6 ...

Les raies de Paschen sont dans la région du proche infrarouge et le niveau final est n = 3, c'est-à-dire que leurs valeurs se produisent lorsque l'électron se désintègre de niveaux supérieurs à n = 3. Puisque la série de Lyman est dans l'ultraviolet, il conclut que la série de Balmer se situe entre Lyman et Paschen.
Série Brackett
Cette série, découverte en 1922 par Frederick Brackett, physicien américain, se situe dans l'infrarouge lointain et se compose des raies spectrales correspondant aux transitions hydrogène commençant à n = 5 et se poursuivant:

Série Pfund
La série Pfund a été trouvée en 1924 par le physicien nord-américain August Hermann Pfund et fait référence aux transitions qui commencent à n = 5, dans la bande infrarouge lointain:

- Arny, T. 2017. Explorations: Une introduction à l'astronomie. 8ème. Ed. McGraw Hill.
- Bauer, W. 2011. Physique pour l'ingénierie et les sciences. Volume 2. Mc Graw Hill.
- Chang, R. 2013. Chimie. 11ème. Édition. Éducation Mc Graw Hill.
- Sears, Zemansky. 2016. Physique universitaire et physique moderne. 14e. Éd. Volume 2. Pearson.
- Des fenêtres ouvertes sur l'univers. Les différentes classes de spectres. Récupéré de: media4.obspm.fr.



Personne n'a encore commenté ce post.