
Structure du silicate de sodium (Na2SiO3), propriétés, utilisations, risques

le silicate de sodium est un composé inorganique formé de deux ions sodium Na+ et un anion silicate SiO3deux-. On dit aussi qu'il est constitué d'une molécule de silice SiOdeux et un oxyde de sodium NadeuxO. Sa formule chimique peut être exprimée en NadeuxOui3 ou aussi NadeuxOU ALORS.Ouideux.
Cependant, la composition du silicate de sodium peut varier en fonction du rapport SiOdeux/ N / AdeuxSoit en poids, soit en moles. Il est également appelé silicate soluble ou verre à eau. Il peut être obtenu sous forme de poudre, de gros morceaux cristallins ou sous forme de solutions.

Le silicate de sodium est largement utilisé dans les détergents et les savons car il adoucit l'eau, ce qui rend le nettoyage plus efficace. Il fait également partie de produits tels que la crème à raser.
C'est la matière première pour préparer les catalyseurs de silice SiOdeux. Ses solutions sont utilisées comme colle dans de nombreuses applications, allant du papier et carton adhésif, au verre, à la porcelaine, aux moules réfractaires, au ciment et aux disques abrasifs..
Parce qu'il s'agit d'un matériau totalement incombustible, il est utilisé pour fabriquer des tissus ignifuges, car il est ignifuge et comme revêtement pour les équipements de protection..
Index des articles
- 1 Structure
- 2 Nomenclature
- 3 propriétés
- 3.1 État physique
- 3.2 Poids moléculaire
- 3.3 Point de fusion
- 3.4 Densité
- 3.5 Solubilité
- 3,6 pH
- 3.7 Propriétés chimiques
- 3.8 Autres propriétés
- 4 Obtention
- 5 utilisations
- 5.1 Dans les savons et détergents
- 5.2 Dans les catalyseurs et les gels de silice
- 5.3 Comme adhésif ou colle
- 5.4 Dans les fluides de forage de puits de pétrole
- 5.5 Dans diverses applications
- 6 risques
- 7 Références
Structure
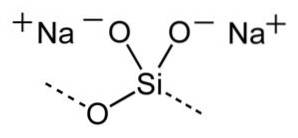
La formule générale des silicates de sodium est xSiOdeux/ N / AdeuxOu où x est le rapport molaire ou pondéral.
Le rapport molaire signifie le nombre de moles de SiOdeux divisé par le nombre de moles de NadeuxO. Le rapport pondéral signifie le poids de SiOdeux divisé par le poids de NadeuxOU ALORS.
Ajout de plus d'alcali (NadeuxO) le rapport molaire ou pondéral est modifié.
Une solution de silicate de sodium à faible rapport molaire, par exemple 1/1 (1 mole de SiOdeux et 1 mole de NadeuxO) contient principalement des monomères SiO44- et dimères SdeuxOU ALORS5deux- en plus des ions Na+.
Une solution avec un rapport molaire élevé tel que 3,3 / 1 (3,3 moles de SiOdeux pour chaque mole de NadeuxO) a une forte proportion d'espèces polymériques ou de polymères de silicium et d'oxygène.
Nomenclature
-Silicate de sodium
-Métasilicate de sodium
-Verre soluble
-Verre d'eau (de l'anglais verre d'eau)
-Silicate soluble
Propriétés
État physique
-Solide en gros morceaux qui ressemblent à des cristaux vert bleuâtre
-Solide poudreux incolore à blanc
-Solutions aqueuses incolores.
Poids moléculaire
De la formule NadeuxOui3: 122,063 g / mol.
Point de fusion
N / AdeuxOui3: 1089 ° C
Densité
Cela dépend du rapport SiOdeux/ N / AdeuxOU ALORS.
Solubilité
Lorsqu'il se présente sous la forme de gros morceaux de cristal verdâtre, il est soluble dans l'eau s'il est chauffé et sous haute pression. La poudre est légèrement plus soluble, mais dans les deux cas sa solubilité dépend de la quantité de sodium ou de NadeuxOu qu'il possède.
Plus la teneur en sodium est élevée (sous forme de NadeuxO) se dissout plus rapidement.
pH
Ses solutions aqueuses sont fortement alcalines.
Propriétés chimiques
Préparé commercialement dans les relations SiOdeux/ N / AdeuxOu en poids allant de 1,5 à 3,3. À mesure que le SiO augmentedeux dans la relation diminue la solubilité dans l'eau et l'alcalinité.
La dissolution du silicate solide dans l'eau peut former des mélanges gélatineux ou très visqueux.
La poudre de silicate de sodium peut être déliquescente, c'est-à-dire si elle contient une grande quantité de NadeuxOu, il a tendance à absorber facilement l'eau de l'environnement.
Si le pH de ses solutions est abaissé en ajoutant de l'acide, un gel se forme.
Autres propriétés
Ce n'est pas inflammable.
Obtention
Le sable de silice SiO est fondu pour obtenir des silicates de sodiumdeux avec du carbonate de sodium NadeuxCO3 anhydre dans un four ouvert. Le rapport molaire du sable au carbonate de sodium peut varier commercialement de 0,5 à 3,75.

Applications
Dans les savons et détergents
Les silicates de sodium sont parmi les premiers composés utilisés dans les formulations détergentes.

Le silicate de sodium séquestre les ions calcium Cadeux+ et magnésium Mgdeux+, éliminer ce qu'on appelle la dureté de l'eau, c'est-à-dire l'adoucir. En faisant cela, des précipités insolubles se forment, il est donc utilisé en petites quantités.
L'action du silicate de sodium permet au détergent de fonctionner sans que les ions mentionnés n'affectent le processus de nettoyage.
Dans les gels et catalyseurs de silice
Les gels de silice sont généralement préparés en acidifiant une solution de silicate de sodium à un pH inférieur à 10 ou 11. Le temps nécessaire pour gélifier varie..

La silice peut être préparée en mélangeant du silicate de sodium avec un acide minéral fort. Le silicate de sodium est utilisé dans la fabrication de bases pour catalyseurs, car il est la source de silice SiOdeux.
Comme adhésif ou colle
Des solutions aqueuses concentrées de silicate de sodium sont utilisées comme adhésifs et mastics. Ils peuvent résister à des températures allant jusqu'à 1100 ° C.
Les principales applications des colles au silicate de sodium sont le papier adhésif, le carton ondulé ou ondulé, les boîtes et les cartons. Également pour coller ou agglomérer du bois ou pour coller du métal sur différents types de matériaux.

Il est utilisé pour coller le verre, la porcelaine, la céramique, les textiles, le cuir, etc. Pour coller des récipients en fibre de verre, en verre optique et en verre résistant aux chocs.
Il permet de préparer des ciments réfractaires pour construire des cuves, des bouilloires, des fours et des moules pour la coulée de métal, ainsi que pour fabriquer des mortiers ou ciments imperméables ou résistants aux acides..
Les silicates de sodium peuvent réagir avec les fluorures de silicium pour produire des ciments résistants aux acides avec une faible tendance au rétrécissement et une dilatation thermique similaire à celle de l'acier..
Ils sont également utilisés pour fabriquer des ciments pour les disques abrasifs utilisés pour le polissage..
Dans les fluides de forage de puits de pétrole
Le silicate de sodium est utilisé depuis de nombreuses années comme boue chimique lors du forage de certains types de formations à très haute perméabilité, comme celles constituées de sable..
Haute perméabilité signifie qu'il laisse passer facilement les liquides.
Il est ajouté avec un composé qui active le silicate pour former un polymère. Ce polymère apporte résistance, rigidité et réduit la perméabilité dans les sols granulaires..
Le sol étant moins perméable, le liquide ne le traverse pas librement et de cette manière la perte de fluide est évitée pendant la phase de forage du puits.
Dans diverses applications
Le silicate de sodium a également une variété d'utilisations. Voilà quelque.
-Dans les produits de soins quotidiens, par exemple, il fait partie des crèmes à raser.
-Dans le traitement de l'eau.
-Dans le blanchiment de textiles tels que la laine.
-Dans le blanchiment de la pâte à papier. Par exemple, pour blanchir le bois broyé, un mélange contenant du peroxyde d'hydrogène et du silicate de sodium entre autres ingrédients est utilisé. Le silicate de sodium est utilisé pour séquestrer les ions métalliques, qui ont tendance à accélérer la décomposition du peroxyde..
-Pour la fabrication de tissus ignifuges. Comme ignifuge et comme revêtement pour les équipements de protection.
-Dans les pigments de silice.
-Détecter les grains de maïs infestés par les insectes. Un mélange de silicate de sodium et d'eau est utilisé où les grains infestés flottent rapidement à la surface.
-En zingage.
-Pour nettoyer les métaux.
-En flottation minérale, il est utilisé comme dispersant pour les boues et le limon et comme conditionneur pour la surface des minéraux..
-Pour imprégner le bois.
Des risques
Le silicate de sodium, en raison de sa forte teneur en alcali, est un irritant puissant pour la peau, les yeux et les muqueuses. En cas d'ingestion, il peut être toxique et irriter les muqueuses de la même manière que les solutions de soude caustique..
Il doit être stocké séparément des acides forts, des métaux et des halogènes tels que le fluor, avec lesquels il réagit violemment.
Les références
- Ebnesajjad, S. (2015). Caractéristiques des matériaux adhésifs. Silicates solubles (silicate de potassium et de sodium). In Handbook of Adhesives and Surface Preparation. Récupéré de sciencedirect.com.
- Fink, J.K. (2012). Additifs de perte de fluide. Métasilicate de sodium. In Petroleum Engineer's Guide to Oil Field Chemicals and Fluids (deuxième édition). Récupéré de sciencedirect.com.
- NOUS. Bibliothèque nationale de médecine. (2019). Silicate de sodium. Centre national d'information sur la biotechnologie. Récupéré de pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer. (1984). Encyclopedia of Chemical Technology, 3e éd., John Wiley and Sons.
- Maeda, K. et coll. (2007). Des zéolithes aux matériaux MOF poreux - Les 40e Anniversaire de la Conférence internationale sur les zéolites. Dans les études en science des surfaces et en catalyse. Récupéré de sciencedirect.com.
- Chopade, S.P. et Nagarajan, K. (2000). Formulations détergentes: échange d'ions. Dans Encyclopedia of Separation Science. Récupéré de sciencedirect.com.
- .



Personne n'a encore commenté ce post.