
Structure, utilisations, toxicité du sulfate d'aluminium (Al2 (SO4) 3)

le sulfate d'aluminium est un sel d'aluminium inorganique de formule Aldeux(SW4)3, qui apparaît généralement comme un solide blanc avec des cristaux brillants. La couleur du composé sera influencée par sa concentration en fer et toutes autres impuretés. Il existe deux principaux types de sulfate d'aluminium: A et B.
L'image du bas montre des cristaux blancs de sulfate d'aluminium hydraté. L'absence de colorations brunes peut être notée, indiquant des ions de fer dans le réseau cristallin.

Le sulfate d'aluminium est un sel très soluble dans l'eau et dans la nature il est rare de le trouver sous sa forme anhydre. Il est généralement hydraté sous forme de sulfate d'aluminium octadécahydraté [Aldeux(SW4)3.18HdeuxO] ou hexadécahydraté [Aldeux(SW4)3.16HdeuxOU ALORS].
De même, il peut former des sels doubles avec le potassium et avec l'ammonium, des composés connus sous le nom d'alun. Cela peut être en partie dû à l'affinité de l'eau contenue dans les hydrates pour retenir des ions autres que l'aluminium..
Le sulfate d'aluminium peut être décomposé par l'action de l'eau en hydroxyde d'aluminium et en acide sulfurique. Cette propriété a permis son utilisation comme acidifiant du sol..
C'est aussi un composé toxique, surtout au contact de sa poussière. Cependant, il a une myriade d'utilisations et d'applications allant de la purification de l'eau à l'aide de la méthode de coagulation, en passant par son utilisation dans diverses industries, à son utilisation à des fins thérapeutiques..
Index des articles
- 1 Structure
- 2 À quoi sert-il (utilisations)
- 2.1 Coagulation ou floculation de l'eau
- 2.2 Utilisation comme mordant d'encre et dans la fabrication du papier
- 2.3 Utilisations industrielles
- 2.4 Utilisations médicinales et thérapeutiques
- 2.5 Autres utilisations
- 3 Production de sulfate d'aluminium
- 4 types
- 5 Toxicité
- 6 Références
Structure
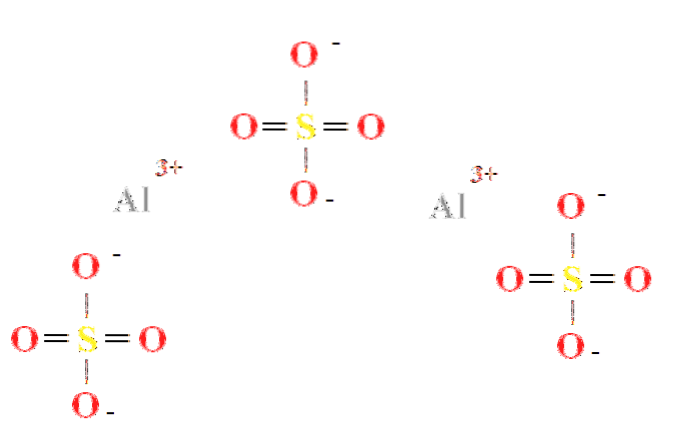
Le sulfate d'aluminium a un rapport de deux cations Al3+ pour trois anions SO4deux- (image du haut), visible directement dans sa formule chimique Aldeux(SW4)3.
Notez que l'Al3+ sont de couleur grisâtre, tandis que les SO4deux- ils sont jaunes (pour l'atome de soufre) et rouges (pour les atomes d'oxygène).
La structure illustrée correspond à la forme anhydre d'Aldeux(SW4)3, car aucune molécule d'eau n'interagit avec les ions. Dans ses hydrates, cependant, l'eau peut être attirée par les centres positifs d'Al3+, ou par les tétraèdres négatifs de SO4deux- par liaison hydrogène (HOH- O-SO3deux-).
L'Aldeux(SW4)3∙ 18HdeuxOu, par exemple, il contient 18 molécules d'eau dans sa structure solide. Certains d'entre eux peuvent être en contact direct avec l'Al3+ ou avec le SO4deux-. En d'autres termes: le sulfate d'aluminium peut avoir de l'eau de coordination interne ou externe.
De même, sa structure peut héberger d'autres cations tels que Fe3+, N / A+, K+, etc. Mais pour cela, la présence de plus d'anions SO est nécessaire4deux-. Pour que? Pour neutraliser l'augmentation des charges positives due aux impuretés métalliques.
Le sulfate d'aluminium peut avoir de nombreuses structures, bien que ses hydrates aient tendance à adopter le système cristallin monoclinique.
Proprietes physiques et chimiques
Apparence
Se présente sous la forme d'un solide avec des cristaux, des granules ou de la poudre blancs brillants.
Poids moléculaire
342,31 g / mol (anhydre).
Odeur
C'est inodore
Goût
Goût sucré légèrement astringent.
Point de fusion
Forme anhydre à 770 ° C (forme octadécahydratée à 86,5 ° C)
Solubilité dans l'eau
31,2 g / 100 ml à 0 ° C; 36,4 g / 100 ml à 20 ° C et 89 g / 100 ml à 100 ° C.
Densité
2,67 à 2,71 g / cm3.
Solubilité
Légèrement soluble dans l'alcool éthylique.
La pression de vapeur
Essentiellement zéro.
Stabilité
Stable dans l'air.
Décomposition
Lorsqu'il est chauffé, approximativement à son point de fusion, il peut se décomposer, émettant notamment de l'oxyde de soufre, un gaz toxique..
Corrosivité
Les solutions de sulfate d'aluminium sont corrosives pour l'aluminium. De même, le composé peut corroder les métaux en présence d'humidité..
pKa
3,3 à 3,6. Et son pH est de 2,9 ou plus dans une solution aqueuse à 5%.
À quoi ça sert (utilisations)
Coagulation ou floculation de l'eau
-Al mezclarse con el agua (potable, servida o de desecho), el sulfato de aluminio origina hidróxido de aluminio, el cual forma complejos con los compuestos y las partículas en solución acelerando su sedimentación, lo cual en ausencia del tratamiento con sulfato de aluminio tardaría beaucoup de temps.
-Le sulfate d'aluminium est également utilisé pour nettoyer l'eau de piscine, ce qui la rend plus attrayante à utiliser..
-En utilisant du sulfate d'aluminium, on obtient une eau dépourvue de turbidité et de couleur, augmentant sa potabilité en facilitant le nettoyage de l'eau. Malheureusement, cette méthode de purification peut conduire à une concentration légèrement accrue d'aluminium dans l'eau..
-L'aluminium est un métal très toxique qui s'accumule dans la peau, le cerveau et les poumons, provoquant de graves troubles. De plus, on ne sait pas quelle fonction il remplit chez les êtres vivants..
-L'Union européenne exige que la limite maximale autorisée pour l'aluminium dans l'eau ne dépasse pas 0,2 mg / l. Pendant ce temps, l'Enviromental Protection Agency des États-Unis exige que la limite maximale de contamination de l'eau par l'aluminium ne dépasse pas 0,05-0,2 mg / l.
-Le traitement des eaux usées ou des eaux usées avec du sulfate d'aluminium permet l'élimination ou la réduction du phosphore qu'elles contiennent, de manière économique.
Utilisation comme mordant d'encre et dans la fabrication du papier
-Le sulfate d'aluminium a été utilisé comme mordant dans les colorants ou les encres, aidant à se fixer sur le matériau à teindre. Son action fixante est due à Al (OH)3, dont la consistance gélatineuse collabore à l'adsorption de colorants sur les textiles.
-Bien qu'il soit utilisé depuis environ 2000 ans avant JC pour le but décrit, seuls les colorants organiques nécessitent des mordants. Les colorants synthétiques, par contre, ne nécessitent pas de mordants pour remplir leur fonction..
-Il a été déplacé de la fabrication du papier, mais est toujours utilisé dans la fabrication de pâte à papier. Il élimine ses impuretés et a également été utilisé pour lier les matériaux, neutraliser les charges et calibrer la colophane..
Usages industriels
-Il est utilisé dans l'industrie de la construction afin d'accélérer la prise du béton. De plus, il est utilisé dans l'imperméabilisation des constructions.
-Dans l'industrie du savon et des graisses, il est utilisé dans la production de glycérine.
-Il est utilisé dans l'industrie pétrolière dans la production de catalyseurs synthétiques qu'ils utilisent lors de leur fonctionnement..
-Il est utilisé dans l'industrie pharmaceutique comme astringent dans la préparation de médicaments et de cosmétiques.
-Il participe à l'élaboration de colorants comme le carmin. Il est également utilisé comme colorant dans la fabrication de caoutchoucs synthétiques de styrène butadiène..
-Dans l'industrie de la fabrication du sucre, il est utilisé comme purificateur pour la mélasse de canne à sucre.
-Il est utilisé dans la fabrication de déodorants. Parce que? Parce qu'il provoque un rétrécissement des canaux des glandes sudoripares, limitant ainsi l'accumulation de sueur, un milieu nécessaire à la croissance des bactéries responsables des odeurs.
-Il est utilisé dans le tannage du cuir, procédé nécessaire à son utilisation. De plus, il est utilisé dans la fabrication d'engrais.
-Il est utilisé comme additif dans la fabrication de peintures, d'adhésifs et de mastics, ainsi que de produits de nettoyage et d'entretien des meubles..
Utilisations médicinales et thérapeutiques
-Le sulfate d'aluminium est un adjuvant immunitaire. Par conséquent, il remplit la fonction de traiter les antigènes de telle manière que lorsqu'ils sont libérés dans leur site d'action, ils produisent une plus grande production d'anticorps pour les antigènes qui ont été inoculés..
-L'adjuvant de Freund et le BCG, ainsi que d'autres adjuvants, y compris des adjuvants endogènes tels que les interleukines, ne sont pas spécifiques des antigènes, permettant une augmentation du rayon d'action immunitaire. Cela a permis le développement de vaccins contre de nombreuses maladies.
-L'action coagulante du sulfate d'aluminium a permis l'élimination de nombreux virus dans l'eau traitée, entre autres: Q beta, MS2, T4 et P1. Les résultats indiquent que le traitement de l'eau avec du sulfate d'aluminium produit une inactivation de ces virus..
-Le sulfate d'aluminium est utilisé sous forme de bâtonnet ou de poudre dans le traitement des petites plaies superficielles ou des abrasions produites par le rasage..
-Il est utilisé dans la fabrication d'acétate d'aluminium, un composé utilisé dans le traitement de certaines affections de l'oreille. Il a également été utilisé, sans succès significatif, pour atténuer les conséquences des piqûres de fourmis de feu..
-Des solutions de sulfate d'aluminium sont utilisées, à une concentration de 5% à 10%, dans le traitement local des ulcères qui permettent le contrôle de leurs sécrétions.
-L'action astringente du sulfate d'aluminium contracte les couches superficielles de la peau, coagule les protéines et cicatrise les plaies.
Autres utilisations
-Le sulfate d'aluminium aide à contrôler la croissance excessive d'algues dans les étangs, les lacs et les ruisseaux. Il est également utilisé dans l'élimination des mollusques, entre autres la limace espagnole.
-Les jardiniers appliquent ce composé pour acidifier les sols alcalins. Au contact de leur eau, le sulfate d'aluminium se décompose en hydroxyde d'aluminium et dilue l'acide sulfurique. Ensuite, l'hydroxyde d'aluminium précipite, laissant l'acide sulfurique en solution..
-L'acidification des sols due à l'acide sulfurique se visualise de manière très créative, en raison de l'existence d'une plante appelée Hydrangea, dont les fleurs deviennent bleues en présence d'un sol acide; c'est-à-dire qu'ils sont sensibles et réagissent aux changements de pH.
-Le sulfate d'aluminium est impliqué dans la production d'une mousse pour combattre et contrôler le feu. Comment? Réagit avec le bicarbonate de sodium, provoquant la libération de COdeux. Ce gaz bloque l'accès de l'Odeux au site de combustion du matériau; et par conséquent le cessez-le-feu qui se déroulait.
Production de sulfate d'aluminium
Le sulfate d'aluminium est synthétisé en faisant réagir un composé riche en aluminium, tel que la bauxite minérale, avec de l'acide sulfurique à des températures élevées. L'équation chimique suivante représente la réaction:
AudeuxOU ALORS3 + HdeuxSW4 -> Aldeux(SW4)3 + 3 HdeuxOU ALORS
Le sulfate d'aluminium peut également être formé par une réaction de neutralisation entre l'hydroxyde d'aluminium et l'acide sulfurique, selon la réaction suivante:
2 Al (OH)3 + 3 HdeuxSW4 + 12 heuresdeuxO -> Aldeux(SW4)3.18HdeuxOU ALORS
L'acide sulfurique réagit avec l'aluminium pour former du sulfate d'ammonium et libérer des molécules d'hydrogène sous forme de gaz. La réaction est décrite comme suit:
2 Al + 3 HdeuxSW4 -> Aldeux(SW4)3 + 3 Hdeux
Les types
Le sulfate d'aluminium est classé en deux types: type A et type B.Dans le sulfate d'aluminium de type A, les solides sont de couleur blanche et ont une concentration en fer inférieure à 0,5%.
Dans le sulfate d'aluminium de type B, les solides sont de couleur brune et ont une concentration en fer inférieure à 1,5%.
Il existe des industries qui produisent du sulfate d'aluminium qui ont des critères différents pour sa classification. Ainsi, une industrie rapporte pour sa préparation de sulfate d'aluminium de type A une concentration maximale de 0,1% de fer sous forme d'oxyde ferrique. Alors que pour le type B, ils indiquent une concentration maximale de fer de 0,35%.
Toxicité
-Le sulfate d'aluminium est un composé qui exerce son action toxique par contact avec sa poussière, provoquant ainsi une irritation de la peau, et en cas de contact fréquent, une dermatite..
-Dans les yeux, il provoque une irritation sévère, provoquant même des blessures permanentes.
-L'inhalation provoque une irritation du nez et de la gorge, ce qui peut provoquer une toux et une forte.
-Son ingestion provoque une irritation gastrique, des nausées et des vomissements.
-Il existe des effets toxiques qui ne sont pas directement dus au sulfate d'aluminium, mais indirectement dus à son utilisation. C'est le cas de certains effets toxiques de l'aluminium, provoqués par l'utilisation du sulfate d'aluminium dans la purification de l'eau..
-Les patients dialysés de manière chronique à l'aide de sels préparés dans de l'eau purifiée, grâce à l'utilisation de sulfate d'aluminium, souffrent de troubles de santé très graves. Parmi ces troubles, nous avons l'anémie, la démence par dialyse et une augmentation des maladies osseuses.
Les références
- Wikipédia. (2018). Sulfate d'aluminium. Tiré de: en.wikipedia.org
- Aris Industrial. Solution de sulfate d'aluminium de type A et B. Extrait de: aris.com.pe
- Christopher Boyd. (9 juin 2014). Principales utilisations industrielles du sulfate d'aluminium. Tiré de: chemservice.com
- PubChem. (2018). Sulfate d'aluminium anhydre. Tiré de: pubchem.ncbi.nlm.nih.gov
- Andesia Chemicals. (20 août 2009). Fiche de sécurité en sulfate d'aluminium. [PDF]. Tiré de: andesia.com
- Livre chimique. (2017). Sulfate d'aluminium. Tiré de: Chemicalbook.com


Personne n'a encore commenté ce post.