
Structure chimique, propriétés et utilisations du sulfate d'ammonium

le sulfate d'ammonium C'est un sel inorganique ammoniacal ternaire d'acide sulfurique. Sa formule chimique est (NH4)deuxSW4. Par conséquent, les proportions stoechiométriques indiquent que pour chaque anion sulfate, il y a deux cations ammonium interagissant avec lui. Cela permet la neutralité du sel ((+1) ∙ 2 + (-2)).
Sa nomenclature est due au fait qu'il s'agit d'un sel dérivé de HdeuxSW4, changer le suffixe "uric" par "ato". Ainsi, les deux protons initiaux sont remplacés par NH4+, produit de la réaction avec l'ammoniac (NH3). Ainsi, l'équation chimique pour sa synthèse est: 2 NH3 + HdeuxSW4 => (NH4)deuxSW4
Le sulfate d'ammonium est un tampon d'azote et de soufre, tous deux essentiels dans la chimie du sol et les engrais..
Index des articles
- 1 Structure chimique
- 2 Propriétés physiques et chimiques
- 2.1 Poids moléculaire
- 2.2 Apparence physique
- 2.3 Odeur
- 2.4 Point de fusion
- 2.5 Solubilité
- 2.6 Densité
- 2.7 Pression de vapeur
- 2.8 Point d'éclair
- 2,9 pH
- 2.10 Stabilité
- 2.11 Décomposition
- 2.12 Corrosion
- 3 utilisations
- 3.1 Dans l'agriculture
- 3.2 En tant que réactif analytique
- 3.3 Dans la précipitation et l'isolement des protéines
- 3.4 Dans l'industrie
- 3.5 Autres utilisations
- 4 Références
Structure chimique
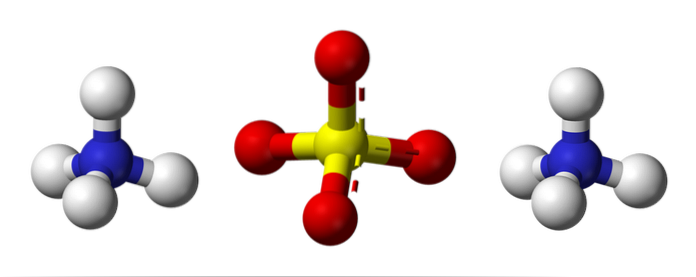
L'image du haut illustre les géométries moléculaires des ions NH4+ Et donc4deux-. Les sphères rouges correspondent aux atomes d'oxygène, les sphères blanches aux atomes d'hydrogène, le bleu à l'atome d'azote et le jaune à l'atome de soufre.
Les deux ions peuvent être considérés comme deux tétraèdres, ayant ainsi trois unités qui interagissent pour former un arrangement cristallin orthorhombique. L'anion sulfate est SO4deux- et est capable de donner ou d'accepter quatre liaisons hydrogène, tout comme le cation NH4+.
Proprietes physiques et chimiques
Poids moléculaire
132,134 g / mol.
Aspect physique
Blanc uni. Cristaux orthorhombiques blancs ou bruns, selon les niveaux d'impureté.
Odeur
Toilette.
Point de fusion
280 ° C Ce point de fusion, bas par rapport aux autres composés ioniques, est dû au fait qu'il s'agit d'un sel avec des cations monovalents (+1) et avec des ions dissemblables dans leurs tailles, ce qui fait que le solide a une énergie de réseau cristallin faible..
Solubilité
76,4 g / 100 g d'eau à 25 ° C Cette affinité pour l'eau est due à la grande capacité de ses molécules à solvater les ions ammonium. En revanche, il est insoluble dans l'acétone et l'alcool; c'est-à-dire dans des solvants moins polaires que l'eau.
Densité
1,77 g / cm3 à 25 ºC.
La pression de vapeur
1 871 kPa à 20 ºC.
point de rupture
26 ºC.
pH
5,0 à 6,0 (solution 1 M à 25 ° C). Le pH légèrement acide est dû à l'hydrolyse du NH4+ dans l'eau, produisant H3OU ALORS+ à faibles concentrations.
Stabilité
Stable dans des conditions environnementales appropriées. En contact avec des oxydants forts, il peut s'enflammer.
Décomposition
Il commence à se décomposer à 150 ° C, libérant des fumées toxiques d'oxyde de soufre, d'oxyde d'azote et d'ammonium.
Corrosion
N'attaque ni le fer ni l'aluminium.
Applications

Dans l'agriculture
- Le sulfate d'ammonium est utilisé comme engrais dans les sols alcalins. Le sel d'ammonium a dans sa composition 21% d'azote et 24% de soufre. Cependant, il existe des composés qui fournissent une plus grande quantité d'azote que le sulfate d'ammonium; l'avantage de ce dernier est sa forte concentration en soufre.
- Le soufre est essentiel dans la synthèse des protéines, car plusieurs acides aminés - tels que la cystine, la méthionine et la cystéine - contiennent du soufre. Pour ces raisons, le sulfate d'ammonium continue d'être l'un des engrais les plus importants.
- Il est utilisé dans les cultures de blé, de maïs, de riz, de coton, de pommes de terre, de chanvre et d'arbres fruitiers.
- Il abaisse le pH des sols alcalins en raison de sa contribution au processus de nitrification effectué par les microbes. Ammonium (NH4+) pour produire du nitrate (NO3-) et relâchez H+: 2NH4+ + 4edeux => 2NON3- + 2HdeuxO + 4H+. L'augmentation de la concentration d'hydrogène abaisse le pH des sols alcalins et permet une plus grande utilisation.
- En plus de son utilisation comme engrais, le sulfate d'ammonium agit comme un complément aux insecticides, herbicides et fongicides solubles, qui sont pulvérisés sur les cultures..
- Le sulfate est capable de séquestrer les ions présents dans le sol et dans l'eau d'irrigation qui sont nécessaires à la vie de certains pathogènes. Parmi les ions que le sulfate d'ammonium capture sont Cadeux+, le Mgdeux+, Foideux+ et la foi3+. Cette action renforce l'effet microbicide des agents mentionnés..
En tant que réactif analytique
Le sulfate d'ammonium agit comme agent précipitant dans l'analyse électrochimique, dans le milieu de culture microbiologique et dans la préparation de sels d'ammonium..
Dans la précipitation et l'isolement des protéines
Le sulfate d'ammonium est utilisé dans l'isolement et la purification des protéines, en particulier celles du plasma. Une quantité de sulfate d'ammonium est ajoutée au plasma pour l'amener à une certaine concentration; ainsi, la précipitation d'un groupe de protéines est provoquée.
Le précipité est recueilli par centrifugation et une quantité supplémentaire de sulfate d'ammonium est ajoutée au surnageant et, à une nouvelle concentration, la précipitation d'un autre groupe de protéines se produit..
La répétition du procédé précédent de manière séquentielle permet par conséquent l'obtention de différentes fractions de protéines plasmatiques.
Avant l'apparition des nouvelles technologies de biologie moléculaire, cette procédure permettait d'isoler des protéines plasmatiques d'une grande importance en médecine, par exemple: immunoglobulines, facteurs de coagulation, etc..
Dans l'industrie
Le sulfate d'ammonium agit en retardant le début du feu dans l'industrie textile. Il est utilisé comme additif dans l'industrie de la galvanoplastie. Il est également utilisé dans la production de peroxyde d'hydrogène, de chlorure d'ammonium, etc..
Autres utilisations
- Le sulfate d'ammonium est utilisé comme agent de régulation de la pression osmotique et comme agent de précipitation du sel..
- Sous forme de laurylsulfate d'ammonium, il réduit la tension superficielle de l'eau, permettant ainsi la séparation des contaminants en augmentant la dureté de l'eau..
- C'est un agent anticorrosion.
- Il est utilisé comme additif alimentaire qui régule l'acidité de la pâte à farine et du pain.
Les références
- PEID de l'OCDE. (Octobre 2004). Sulfate d'ammonium. [PDF]. Extrait le 27 avril 2018 de: inchem.org
- La société Mosaic. (2018). Sulfate d'ammonium. Extrait le 27 avril 2018 de: cropnutrition.com
- Wikipédia. (2018). Sulfate d'ammonium. Extrait le 27 avril 2018 de: en.wikipedia.org
- Pubchem. (2018). Sulfate d'ammonium. Extrait le 27 avril 2018 de: pubchem.ncbi.nlm.nih.gov UpSticksNGo Crew.
- (23 juillet 2015). [Chiffre]. Extrait le 27 avril 2018 de: flickr.com
- Paula Papp. (22 février 2017). Applications et utilisations du sulfate d'ammonium. Extrait le 27 avril 2018 de: business.com



Personne n'a encore commenté ce post.