
Structure chimique du sulfate de calcium (CaSO4), propriétés, utilisations

le sulfate de calcium C'est un sel ternaire de calcium, de métal alcalino-terreux (M. Becambara), de soufre et d'oxygène. Sa formule chimique est CaSO4, ce qui signifie que pour chaque cation Cadeux+ il y a un anion SO4deux- interagir avec lui. Il constitue un composé à large distribution dans la nature.
Ses formes les plus abondantes sont le CaSO42HdeuxO (gypse) et la forme anhydre CaSO4 (l'anhydrite). Il existe également une troisième forme: le plâtre de Paris, produit en chauffant le plâtre (l'hémidrate, CaSO41 / 2HdeuxOU ALORS). Une partie solide de ce sel ternaire est représentée sur l'image du bas, avec son aspect blanchâtre..

Index des articles
- 1 Structure chimique
- 2 propriétés
- 2.1 Formule moléculaire
- 2.2 Poids moléculaire anhydre
- 2.3 Odeur
- 2.4 Apparence
- 2.5 Densité
- 2.6 Point de fusion
- 2.7 Solubilité
- 2.8 Stabilité
- 3 utilisations
- 3.1 Dans la construction et l'art
- 3.2 Thérapeutique
- 3.3 Dans la transformation des aliments
- 3.4 En tant qu'engrais et conditionneur pour les sols des cultures
- 3.5 Dans la production d'autres composés
- 4 Références
Structure chimique
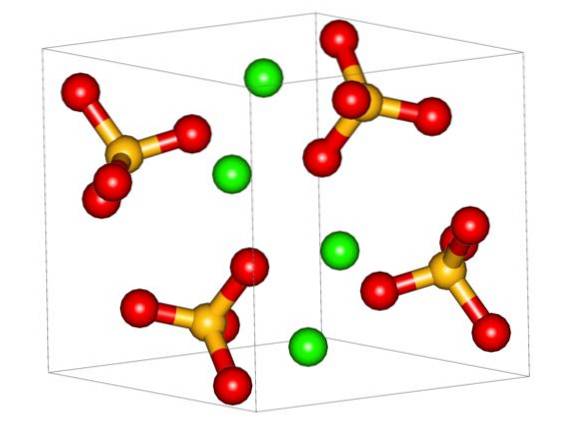
L'image du haut montre la cellule unitaire orthorhombique pour CaSO4. Ici, on suppose que les interactions sont purement électrostatiques; c'est-à-dire que les cations Cadeux+ attirer les anions tétraédriques SO4deux-.
Cependant, le Cadeux+ il est très enclin à se coordonner, formant des structures polyédriques autour de lui. Et c'est due a quoi? À la disponibilité électronique du calcium pour accepter les électrons d'espèces basiques ou négatives (comme les atomes O de SO4deux-).
Compte tenu du point précédent, maintenant les ions Cadeux+ Ils acceptent les liens datifs (fournis par l'Os) et la cellule unitaire est transformée, comme indiqué dans l'image ci-dessous:
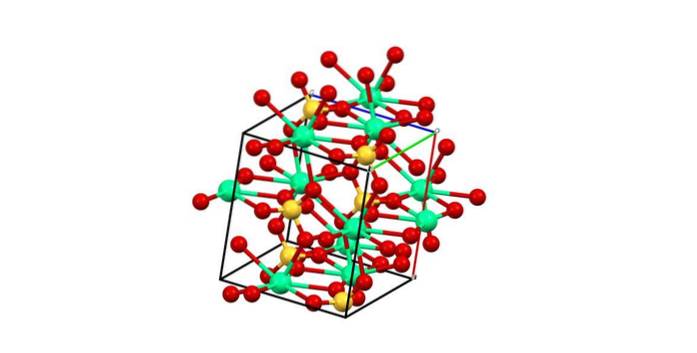
Par conséquent, le polyèdre CaO se forme8 (la sphère verte de Cadeux+ entouré de huit sphères rouges d'O des tétraèdres SO4 proche). Polyèdres de calcium et tétraèdres de sulfate; c'est la structure cristalline du CaSO4 anhydre.
De plus, lorsque les cristaux s'hydratent - formant le sel dihydraté ou l'hémidrate (CaSO41/2 heuredeuxO) - la structure s'agrandit pour incorporer des molécules d'eau.
Ces molécules peuvent s'intercaler et se coordonner avec le calcium; c'est-à-dire qu'ils remplacent un ou deux groupes sulfate.
D'un autre côté, toute l'eau ne fait pas partie du polyèdre CaO.8. Certains, par contre, forment des liaisons hydrogène avec les sulfates. Ceux-ci servent d'union pour deux sections en zigzag, produits de la disposition des ions dans le cristal.
Propriétés
Formule moléculaire
CaSO4 nH2O.
Poids moléculaire anhydre
136,134 g / mol.
Odeur
C'est inodore.
Apparence
Dans le cas de l'anhydrite, il ressemble à une poudre blanche ou à des cristaux solides orthorhombiques ou monocliniques. Les cristaux sont de couleur variable: ils peuvent être blancs ou avec une teinte bleuâtre, grisâtre ou rougeâtre; peut aussi être rouge brique.
Densité
2,96 g / cm3 (forme anhydre). 2,32 gr / cm3 (forme dihydratée).
Point de fusion
1450 ° C (2840 ° F). Caractéristique des fortes interactions électrostatiques entre les ions Ca divalentsdeux+ Et donc4deux-.
Solubilité
0,2-0,3% dans l'eau à 25 ° C Il est peu soluble dans l'eau et insoluble dans l'éthanol.
Stabilité
Stable à température ambiante.
Applications

Dans la construction et dans l'art
Il est utilisé dans l'élaboration du stuc pour friser les murs des maisons et autres constructions qui contribuent à son embellissement. De plus, des reliefs sont réalisés au moyen de moules dans les plafonds et les cadres de fenêtres. Le plâtre est également dans les plafonds.
Le sulfate de calcium est utilisé pour aider à résoudre le problème de l'hydratation du béton, collaborant ainsi à la construction de routes, d'avenues, etc..
Avec les sculptures en plâtre sont faites, en particulier des figures religieuses, et dans les cimetières, elles sont utilisées sur les pierres tombales.
Thérapeutique
vétérinaire
Expérimentalement, en médecine vétérinaire, des morceaux stériles de sulfate de calcium ont été utilisés pour réparer des défauts ou des cavités osseuses, telles que celles laissées par des plaies ou des tumeurs..
Le plâtre de Paris peut être utilisé pour réparer les défauts osseux en raison de sa capacité unique à stimuler l'ostéogenèse. Les études aux rayons X et le médronate de technétium (Tc99m) soutiennent l'utilisation du plâtre de Paris comme alloplastique et sa capacité ostéogénique lorsqu'il est implanté dans le sinus frontal.
La régénération osseuse a été démontrée chez six chiens sur une période de 4 à 6 mois. Le sulfate de calcium a commencé à être utilisé dans ce domaine en 1957, sous forme de comprimés de plâtre de Paris, pouvant combler les défauts des os des chiens..
La substitution osseuse du sulfate de calcium est comparable à celle observée dans l'os autogène.
Ruhaimi (2001) a appliqué du sulfate de calcium sur un os de mâchoire de lapin récemment détruit, observant une augmentation de l'ostéogenèse et de la calcification osseuse..
Médicament
Le sulfate de calcium est utilisé en médecine pour immobiliser les articulations disloquées et les os fracturés, ainsi qu'être utilisé comme excipient dans la fabrication de comprimés..
odontologie
En dentisterie, il est utilisé comme base pour la fabrication de prothèses dentaires, pour les restaurations et les empreintes de dents..
Dans la transformation des aliments
Il est utilisé comme coagulant dans la production de tofu, un aliment à base de soja et largement consommé dans les pays de l'Est comme substitut de la viande. De plus, il a été utilisé comme raffermissement des aliments et dans le traitement des farines.
En tant qu'engrais et conditionneur pour les sols de cultures
Gypse (CaSO42HdeuxO) était utilisé comme engrais en Europe depuis le XVIIIe siècle, ayant l'avantage sur l'utilisation de la chaux comme source de calcium pour une plus grande mobilité.
Le calcium doit être disponible aux racines des plantes pour son approvisionnement adéquat. Ainsi, l'ajout de calcium améliore les cultures horticoles et d'arachide (arachide)..
La pourriture des racines de l'arachide causée par des agents pathogènes biologiques, ainsi que la pourriture apicale de la pastèque et de la fleur de tomate, sont partiellement contrôlées avec des applications de gypse agricole..
Le gypse aide à réduire la dispersion de l'argile, ce qui provoque la formation de croûtes au sol. En réduisant les croûtes formées au sol, l'enduit facilite la sortie des plants. Il augmente également l'entrée d'air et d'eau dans le sol.
Le gypse aide à améliorer le sol en atténuant l'acidité et la toxicité de l'aluminium, adaptant ainsi la culture aux sols sodiques.
Dans la production d'autres composés
Le sulfate de calcium réagit avec le bicarbonate d'ammonium pour former du sulfate d'ammonium. Il a également été utilisé dans le processus de production d'acide sulfurique.
Le sulfate de calcium anhydre est mélangé avec du schiste ou du maigre et, au fur et à mesure que le mélange est chauffé, du trioxyde de soufre est libéré sous forme gazeuse. L'oxyde de soufre est un précurseur de l'acide sulfurique.
Les références
- Smokefoot. (26 décembre 2015). Structure de CaSO4. [Chiffre]. Extrait le 6 mai 2018 de: commons.wikimedia.org
- Takanori Fukami et coll. (2015). Synthèse, structure cristalline et propriétés thermiques du CaSO42HdeuxOu des cristaux uniques. Journal international de chimie; Vol. 7, n ° 2; ISSN 1916-9698 E-ISSN 1916-9701 Publié par le Centre canadien des sciences et de l'éducation.
- PubChem. (2018). Sulfate de calcium. Extrait le 6 mai 2018 de: pubchem.ncbi.nlm.nih.gov
- Wikipédia. (2018). Sulfate de calcium. Extrait le 6 mai 2018 de: en.wikipedia.org
- Elsevier. (2018). sulfate de calcium. Extrait le 6 mai 2018 de: sciencedirect.com
- Kimberlitesoftwares. (2018). Sulfate de calcium. Extrait le 6 mai 2018 de: worldofchemicals.com
- Intagri. (2017). Manuel d'utilisation du gypse agricole comme agent d'amélioration des sols. Extrait le 6 mai 2018 de: intagri.com


Personne n'a encore commenté ce post.