
Tableau périodique de l'histoire des éléments, de la structure, des éléments

La tableau périodique des éléments est un outil qui permet de consulter les propriétés chimiques des 118 éléments connus à ce jour. Il est essentiel pour effectuer des calculs stœchiométriques, prédire les propriétés physiques d'un élément, les classer et trouver des propriétés périodiques parmi tous..
Les atomes deviennent plus lourds à mesure que leurs noyaux ajoutent des protons et des neutrons, qui doivent également être accompagnés de nouveaux électrons; sinon, l'électroneutralité ne serait pas possible. Ainsi, certains atomes sont très légers, comme l'hydrogène, et d'autres, super lourds, comme l'oganeson.
A qui un tel cœur doit-il en chimie? Au scientifique Dmitri Mendeleev, qui en 1869 (il y a près de 150 ans) a publié, après une décennie d'études théoriques et d'expériences, le premier tableau périodique pour tenter d'organiser les 62 éléments connus à l'époque.
Pour cela, Mendeleev s'est appuyé sur les propriétés chimiques, tandis que dans le même temps Lothar Meyer a publié un autre tableau périodique organisé en fonction des propriétés physiques des éléments..
Au départ, le tableau contenait des «espaces vides» dont les éléments n'étaient pas connus à l'époque. Cependant, Mendeleev a pu prédire plusieurs de ses propriétés avec une précision appréciable. Certains de ces éléments étaient: le germanium (qu'il appelait eka-silicium) et le gallium (eka-aluminium).
Les premiers tableaux périodiques classaient les éléments en fonction de leurs masses atomiques. Cet ordre a révélé une certaine périodicité (répétition et similitude) dans les propriétés chimiques des éléments; cependant, les éléments de transition n'étaient pas d'accord avec cet ordre, et les gaz rares non plus.
Pour cette raison, il fallait ordonner les éléments en considérant le numéro atomique (nombre de protons), au lieu de la masse atomique. De là, avec le travail acharné et les contributions de nombreux auteurs, le tableau périodique de Mendeleev a été affiné et complété..
Index des articles
- 1 Histoire du tableau périodique
- 1.1 Éléments
- 1.2 Symbologie
- 1.3 Évolution du schéma
- 1.4 Vis tellurique de Chancourtois (1862)
- 1,5 octaves de Newlands (1865)
- 1.6 La table de Mendeleev (1869)
- 1.7 Tableau périodique de Moseley (tableau périodique actuel) - 1913
- 2 Comment est-il organisé? (Structure et organisation)
- 2.1 Périodes
- 2.2 Groupes
- 2.3 Nombres de protons vs électrons de valence
- 3 Éléments du tableau périodique
- 3.1 Bloc s
- Bloc de 3,2 p
- 3.3 Éléments représentatifs
- 3.4 Métaux de transition
- 3.5 Métaux de transition internes
- 3.6 Métaux et non-métaux
- 3.7 Familles de métal
- 3.8 Métalloïdes
- 3.9 Gaz
- 4 Utilisations et applications
- 4.1 Prédiction des formules d'oxyde
- 4.2 Valences des éléments
- 4.3 Tableaux périodiques numériques
- 5 Importance du tableau périodique
- 6 Références
Histoire du tableau périodique
Éléments
L'utilisation d'éléments comme base pour décrire l'environnement (plus précisément la nature) est utilisée depuis l'Antiquité. Cependant, à cette époque, on les appelait les phases et les états de la matière, et non pas de la manière dont on l'appelait depuis le Moyen Âge..
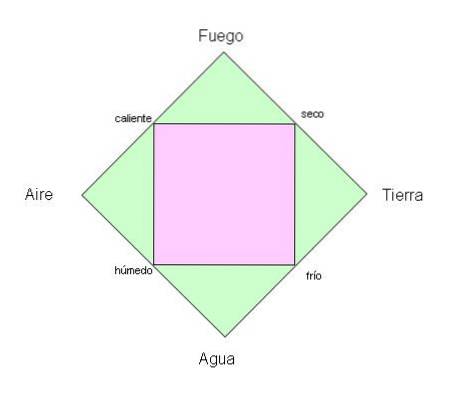
Les Grecs de l'Antiquité croyaient que la planète que nous habitons était composée des quatre éléments fondamentaux: le feu, la terre, l'eau et l'air..
D'autre part, dans la Chine ancienne, le nombre d'éléments était de cinq et, contrairement aux Grecs, ceux-ci excluaient l'air et comprenaient le métal et le bois..

La première découverte scientifique a été faite en 1669 par l'allemand Henning Brand, qui a découvert le phosphore; à partir de cette date, tous les éléments ultérieurs ont été enregistrés.

Il convient de préciser que certains éléments tels que l'or et le cuivre étaient déjà connus avant le phosphore; la différence est qu'ils n'ont jamais été enregistrés.
Symbologie
Les alchimistes (ancêtres des chimistes d'aujourd'hui) ont donné des noms aux éléments en relation avec les constellations, leurs découvreurs et les lieux où ils ont été découverts.
En 1808, Dalton proposa une série de dessins (symboles) pour représenter les éléments. Plus tard, ce système de notation a été remplacé par celui de Jhon Berzelius (utilisé à ce jour), car le modèle de Dalton est devenu plus compliqué à mesure que de nouveaux éléments sont apparus..
Évolution du régime
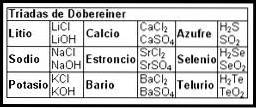
Les premières tentatives de création d'une carte organisant les informations sur les éléments chimiques ont eu lieu au 19ème siècle avec les Triades Döbereiner (1817).
Au fil des années, de nouveaux éléments ont été découverts, donnant naissance à de nouveaux modèles d'organisation jusqu'à celui actuellement utilisé..
Vis Tellurique Chancourtois (1862)
Alexandré-Émile Béguyer de Chancourtois a conçu une hélice en papier montrant un graphique de spirales (vis tellurique).
Dans ce système, les éléments sont classés par ordre croissant par rapport à leur poids atomique. Les articles similaires sont alignés verticalement.
Octaves de Newlands (1865)
Poursuivant les travaux de Döbereiner, le britannique John Alexander Reina Newlands a organisé les éléments chimiques dans un ordre croissant en ce qui concerne les poids atomiques, notant que tous les sept éléments avaient des similitudes dans leurs propriétés (l'hydrogène n'est pas inclus).
Table de Mendeleïev (1869)
Mendeleev a arrangé les éléments chimiques par ordre croissant par rapport au poids atomique, plaçant dans la même colonne ceux dont les propriétés étaient similaires. Il a laissé des lacunes dans son modèle de tableau périodique en anticipant l'apparition de nouveaux éléments dans le futur (en plus de prédire les propriétés qu'il devrait avoir).
Les gaz nobles n'apparaissent pas dans le tableau de Mendeleev, car ils n'avaient pas encore été découverts. De plus, Mendeleiv n'a pas considéré l'hydrogène.
Tableau périodique de Moseley (tableau périodique actuel) - 1913
Henry Gwyn Jeffreys Moseley a proposé d'ordonner les éléments chimiques du tableau périodique en fonction de leur numéro atomique; c'est-à-dire en fonction de son nombre de protons.
Moseley a énoncé la "loi périodique" en 1913: "Lorsque les éléments sont disposés dans l'ordre de leurs numéros atomiques, leurs propriétés physiques et chimiques montrent des tendances périodiques".
Ainsi, chaque ligne ou période horizontale montre un type de relation, et chaque colonne ou groupe en montre un autre..
Comment est-il organisé? (Structure et organisation)
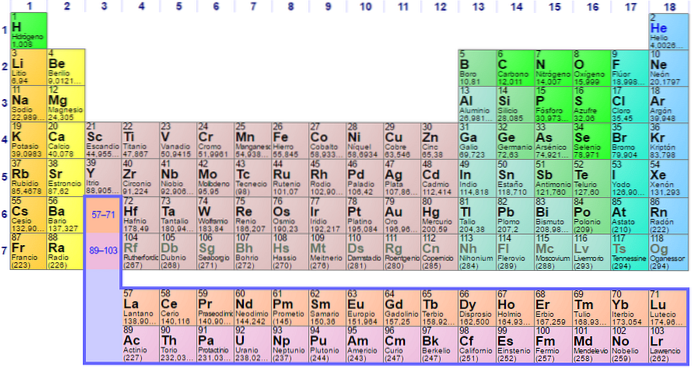
On peut voir que le pastel du tableau périodique a plusieurs couleurs. Chaque couleur associe des éléments aux propriétés chimiques similaires. Il y a des colonnes orange, jaunes, bleues, violettes; carrés verts et diagonale vert pomme.
Notez que les cellules des colonnes du milieu sont de couleur grisâtre, donc tous ces éléments doivent avoir quelque chose en commun, à savoir qu'ils sont des métaux de transition avec des orbitales d à moitié pleines..
De même, les éléments des carrés violets, bien qu'ils passent de substances gazeuses, d'un liquide rougeâtre au solide noir-violet (iode) et gris argenté (astatine), ce sont leurs propriétés chimiques qui en font des congénères. Ces propriétés sont régies par les structures électroniques de ses atomes..
L'organisation et la structure du tableau périodique ne sont pas arbitraires, mais obéissent à une série de propriétés périodiques et de modèles de valeurs déterminés pour les éléments. Par exemple, si le caractère métallique diminue de gauche à droite du tableau, un élément métallique dans le coin supérieur droit ne peut pas être attendu.
Périodes
Les éléments sont disposés en rangées ou périodes en fonction du niveau d'énergie de leurs orbitales. Avant la période 4, lorsque les éléments se succédaient dans un ordre croissant de masse atomique, on a constaté que pour huit d'entre eux, les propriétés chimiques se répétaient à nouveau (loi des octaves de John Newlands).
Les métaux de transition ont été coulés avec d'autres éléments non métalliques, tels que le soufre et le phosphore. Pour cette raison, l'entrée de la physique quantique et des configurations électroniques était vitale pour la compréhension des tableaux périodiques modernes..
Les orbitales d'une couche d'énergie se remplissent d'électrons (et des noyaux de protons et de neutrons) lorsqu'elle se déplace à travers une période. Cette couche d'énergie va de pair avec la taille ou le rayon atomique; par conséquent, les éléments des périodes supérieures sont plus petits que ceux qui sont inférieurs.
H et He sont dans le premier niveau d'énergie (période); la première rangée de carrés grisâtres, dans la quatrième période; et la rangée de carrés orange, en sixième période. Notez que, bien que ce dernier semble être dans la supposée neuvième période, il appartient en fait à la sixième, juste après la boîte jaune de Ba.
Groupes
En passant par une période, on constate que la masse, le nombre de protons et d'électrons augmentent. Dans la même colonne ou le même groupe, bien que la masse et les protons varient, le nombre de électrons de la coquille de valence C'est lui-même.
Par exemple, dans la première colonne ou groupe, le H a un seul électron dans l'orbitale 1s1, comme le Li (2s1), de sodium (3s1), de potassium (4s1) et ainsi de suite jusqu'au francium (7s1). Ce chiffre 1 indique que ces éléments ont à peine un électron de valence et appartiennent donc au groupe 1 (IA). Chaque élément est à des périodes différentes.
Sans compter l'hydrogène en boîte verte, les éléments en dessous sont en boîte orange et sont appelés métaux alcalins. Une autre case à droite dans n'importe quelle période, est le groupe ou la colonne 2; c'est-à-dire que ses éléments ont deux électrons de valence.
Mais en se déplaçant d'un pas plus loin vers la droite, sans la connaissance des orbitales d, on arrive au groupe bore (B) ou au groupe 13 (IIIA); au lieu du groupe 3 (IIIB) ou du scandium (Sc). Compte tenu du remplissage des orbitales d, on commence à passer par les périodes des carrés grisâtres: les métaux de transition.
Nombre de protons vs électrons de valence
Lors de l'étude du tableau périodique, une confusion peut survenir entre le numéro atomique Z ou le nombre de protons totaux dans le noyau et le nombre d'électrons de valence. Par exemple, le carbone a un Z = 6, c'est-à-dire qu'il a six protons et donc six électrons (sinon ce ne pourrait pas être un atome de charge neutre).
Mais, de ces six électrons, quatre sont de valence. Pour cette raison, sa configuration électronique est [He] 2sdeux2 Pdeux. [He] désigne les deux électrons 1sdeux de la couche fermée, et ne participent théoriquement pas à la formation de liaisons chimiques.
En outre, parce que le carbone a quatre électrons de valence, il est "commodément" situé dans le groupe 14 (IVA) du tableau périodique..
Les éléments sous carbone (Si, Ge, Sn, Pb et Fl) ont des numéros atomiques (et des masses atomiques) plus élevés; mais ils ont tous en commun les quatre électrons de valence. Ceci est essentiel pour comprendre pourquoi un élément appartient à un groupe et pas à un autre..
Éléments du tableau périodique
Bloc s
Comme cela vient d'être expliqué, les groupes 1 et 2 sont caractérisés en ce qu'ils ont un ou deux électrons dans s orbitales. Ces orbitales sont de géométrie sphérique, et à mesure que l'on descend à travers l'un de ces groupes, les éléments acquièrent des couches qui augmentent la taille de leurs atomes..
Parce qu'ils présentent de fortes tendances dans leurs propriétés chimiques et leurs modes de réaction, ces éléments sont organisés comme le bloc s. Par conséquent, les métaux alcalins et les métaux alcalino-terreux appartiennent à ce bloc. La configuration électronique des éléments de ce bloc est ns (1s, 2s, etc.).
Bien que l'élément hélium se trouve dans le coin supérieur droit du tableau, sa configuration électronique est de 1sdeux et appartient donc à ce bloc.
Bloquer p
Contrairement au bloc s, les éléments de ce bloc ont des orbitales s complètement remplies, tandis que leurs orbitales p continuent d'être remplies d'électrons. Les configurations électroniques des éléments appartenant à ce bloc sont du type nsdeuxnp1-6 (les orbitales p peuvent avoir un ou jusqu'à six électrons à remplir).
Alors, où se trouve ce bloc dans le tableau périodique? A droite: les carrés verts, violets et bleus; c'est-à-dire les éléments non métalliques et les métaux lourds, tels que le bismuth (Bi) et le plomb (Pb).
En commençant par le bore, avec la configuration électronique nsdeuxnp1, le carbone à sa droite ajoute un autre électron: 2sdeux2 Pdeux. Ensuite, les configurations électroniques des autres éléments de la période 2 du bloc p sont: 2sdeux2 P3 (azote), 2sdeux2 P4 (oxygène), 2sdeux2 P5 (fluor) et 2sdeux2 P6 (néon).
Si vous descendez aux périodes inférieures, vous aurez le niveau d'énergie 3: 3sdeux3p1-6, et ainsi de suite jusqu'à la fin du bloc p.
Notez que la chose la plus importante à propos de ce bloc est que, à partir de la période 4, ses éléments ont des orbitales d complètement remplies (cases bleues à droite). En bref: le bloc s est à gauche du tableau périodique et le bloc p, à droite.
Éléments représentatifs
Quels sont les éléments représentatifs? Ce sont ceux qui, d'une part, perdent facilement des électrons ou, d'autre part, les gagnent pour compléter l'octet de valence. En d'autres termes: ce sont les éléments des blocs s et p.
Leurs groupes se distinguaient des autres par une lettre A à la fin. Ainsi, il y avait huit groupes: de IA à VIIIA. Mais actuellement, le système de numérotation utilisé dans les tableaux périodiques modernes est l'arabe, de 1 à 18, y compris les métaux de transition..
Pour cette raison, le groupe bore peut être IIIA, ou 13 (3 + 10); le groupe carbone, VAT ou 14; et celui des gaz rares, le dernier à droite du tableau, VIIIA ou 18.
Métaux de transition
Les métaux de transition sont tous les éléments des carrés grisâtres. Tout au long de leurs périodes, leurs orbitales d sont remplies, qui sont cinq et peuvent donc avoir dix électrons. Puisqu'ils doivent avoir dix électrons pour remplir ces orbitales, alors il doit y avoir dix groupes ou colonnes.
Chacun de ces groupes dans l'ancien système de numérotation était désigné par des chiffres romains et une lettre B à la fin. Le premier groupe, celui du scandium, était IIIB (3), celui du fer, du cobalt et du nickel VIIIB pour avoir des réactivités très proches (8, 9 et 10), et celui du zinc IIB (12).
Comme on peut le voir, il est beaucoup plus facile de reconnaître les groupes par des chiffres arabes qu'en utilisant des chiffres romains..
Métaux de transition internes
A partir de la période 6 du tableau périodique, les orbitales f deviennent disponibles énergétiquement. Celles-ci doivent être remplies en premier que les orbitales d; et par conséquent, ses éléments sont généralement placés à part pour ne pas trop allonger la table.
Les deux dernières périodes, orange et grise, sont les métaux de transition internes, également appelés lanthanides (terres rares) et actinides. Il y a sept orbitales f, qui ont besoin de quatorze électrons pour se remplir, et donc il doit y avoir quatorze groupes.
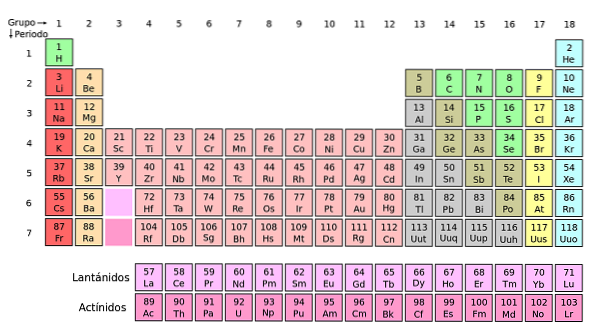
Si ces groupes sont ajoutés au tableau périodique, il y en aura 32 au total (18 + 14) et il y aura une version «longue»:
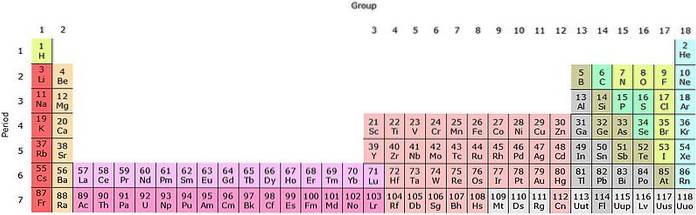
La ligne rose clair correspond aux lanthanoïdes, tandis que la ligne rose foncé correspond aux actinoïdes. Le lanthane, La avec Z = 57, l'actinium, Ac avec Z = 89 et le bloc f entier appartiennent au même groupe que le scandium. Parce que? Parce que le scandium a une orbitale nd1, qui est présent dans le reste des lanthanoïdes et des actinoïdes.
La et Ac ont des paramètres de valence 5d16 sdeux et 6d17 sdeux. Lorsque vous vous déplacez vers la droite sur les deux lignes, les orbitales 4f et 5f commencent à se remplir. Une fois rempli, vous arrivez aux éléments lutetium, Lu et laurencio, Lr.
Métaux et non-métaux
Laissant derrière le gâteau du tableau périodique, il est plus pratique de recourir à celui de l'image supérieure, même sous sa forme allongée. Pour le moment, la grande majorité des éléments mentionnés sont des métaux.
À température ambiante, tous les métaux sont des substances solides (à l'exception du mercure, qui est liquide) de couleur gris argenté (à l'exception du cuivre et de l'or). En outre, ils ont tendance à être durs et brillants; bien que ceux des blocs soient mous et cassants. Ces éléments se caractérisent par leur facilité à perdre des électrons et à former des cations M+.
Dans le cas des lanthanoïdes, ils perdent les trois électrons 5d16 sdeux devenir des cations trivalents M3+ (comme elle3+). Le cérium, pour sa part, est capable de perdre quatre électrons (Ce4+).
D'autre part, les éléments non métalliques constituent la moindre partie du tableau périodique. Ce sont des gaz ou des solides avec des atomes liés de manière covalente (comme le soufre et le phosphore). Tous sont situés dans le bloc p; plus précisément, dans la partie supérieure de celui-ci, car la descente vers les périodes inférieures augmente le caractère métallique (Bi, Pb, Po).
De plus, les non-métaux au lieu de perdre des électrons, vous les gagnez. Ainsi, ils forment des anions X- avec différentes charges négatives: -1 pour les halogènes (groupe 17) et -2 pour les chalcogènes (groupe 16, oxygène).
Familles métalliques
Au sein des métaux, il existe une classification interne pour les différencier les uns des autres:
-Les métaux du groupe 1 sont alcalins
-Groupe 2, métaux alcalino-terreux (M. Becambara)
-Famille de scandium du groupe 3 (IIIB). Cette famille est composée de scandium, chef de groupe, d'yttrium Y, de lanthane, d'actinium, et de tous les lanthanoïdes et actinoïdes.
-Groupe 4 (IVB), famille du titane: Ti, Zr (zirconium), Hf (hafnium) et Rf (rutherfordium). Combien d'électrons de valence ont-ils? La réponse est dans votre groupe.
-Groupe 5 (VB), famille du vanadium. Groupe 6 (VIB), famille du chrome. Et ainsi de suite jusqu'à la famille du zinc, groupe 12 (IIB).
Métalloïdes
Le caractère métallique augmente de droite à gauche et de haut en bas. Mais quelle est la frontière entre ces deux types d'éléments chimiques? Cette bordure est composée d'éléments appelés métalloïdes, qui présentent des caractéristiques à la fois métalliques et non métalliques..
Les métalloïdes peuvent être vus sur le tableau périodique dans «l'échelle» qui commence par le bore et se termine par l'élément radioactif astatine. Ces éléments sont:
-B: bore
-Silicium: Oui
-Ge: germanium
-Comme: arsenic
-Sb: antimoine
-Te: tellure
-À: astatine
Chacun de ces sept éléments présente des propriétés intermédiaires, qui varient en fonction de l'environnement chimique ou de la température. L'une de ces propriétés est la semi-conduction, c'est-à-dire que les métalloïdes sont des semi-conducteurs.
Des gaz
Dans les conditions terrestres, les éléments gazeux sont les métaux non légers, tels que l'azote, l'oxygène et le fluor. De plus, le chlore, l'hydrogène et les gaz rares entrent dans cette classification. De tous, les plus emblématiques sont les gaz rares, en raison de leur faible tendance à réagir et à se comporter comme des atomes libres..
Ces derniers se trouvent dans le groupe 18 du tableau périodique et sont:
-Hélium, il
-Néon, Ne
-Argon, Ar
-krypton, Kr
-Xénon, Xe
-Radon, Rn
-Et le plus récent de tous, l'oganeson de gaz rare synthétique, Og.
Tous les gaz rares ont la configuration de valence ns en commundeuxnp6; c'est-à-dire qu'ils ont l'octet de valence complet.
États d'agrégation des éléments à d'autres températures
Les éléments sont à l'état solide, liquide ou gazeux en fonction de la température et de la force de leurs interactions. Si la température de la Terre se refroidissait autour du zéro absolu (0K), alors tous les éléments gèleraient; à l'exception de l'hélium, qui condenserait.
À cette température extrême, le reste des gaz serait sous forme de glace.
À l'autre extrême, si la température était d'environ 6 000 K, «tous» les éléments seraient à l'état gazeux. Dans ces conditions, vous pourriez littéralement voir des nuages d'or, d'argent, de plomb et d'autres métaux.
Utilisations et applications
Le tableau périodique en lui-même a toujours été et sera un outil de consultation des symboles, masses atomiques, structures et autres propriétés des éléments. Il est extrêmement utile pour effectuer des calculs stoechiométriques, qui sont à l'ordre du jour dans de nombreuses tâches à l'intérieur et à l'extérieur du laboratoire.
Non seulement cela, mais aussi le tableau périodique vous permet de comparer les éléments du même groupe ou période. Ainsi, on peut prédire à quoi ressembleront certains composés des éléments.
Prédiction des formules d'oxyde
Par exemple, pour les oxydes de métaux alcalins, parce qu'ils ont un seul électron de valence, et donc une valence de +1, la formule de leurs oxydes devrait être du type MdeuxO. Ceci est vérifié avec de l'oxyde d'hydrogène, de l'eau, HdeuxO. Également avec des oxydes de sodium, NadeuxO et potassium, KdeuxOU ALORS.
Pour les autres groupes, leurs oxydes doivent avoir la formule générale MdeuxOU ALORSn, où n est égal au numéro de groupe (si l'élément est du bloc p, n-10 est calculé). Ainsi, le carbone, qui appartient au groupe 14, forme du COdeux (CdeuxOU ALORS4/deux); soufre, du groupe 16, SO3 (SdeuxOU ALORS6/deux); et azote, groupe 15, NdeuxOU ALORS5.
Cependant, cela ne s'applique pas aux métaux de transition. En effet, le fer, bien qu'il appartienne au groupe 8, ne peut pas perdre 8 électrons mais 2 ou 3. Par conséquent, au lieu de mémoriser les formules, il est plus important de faire attention aux valences de chaque élément..
Valences des éléments
Les tableaux périodiques (certains) montrent les valences possibles pour chaque élément. Sachant cela, la nomenclature d'un composé et sa formule chimique peuvent être estimées à l'avance. Les valences, comme mentionné précédemment, sont liées au numéro de groupe; bien que cela ne s'applique pas à tous les groupes.
Les valences dépendent davantage de la structure électronique des atomes et des électrons qu'ils peuvent réellement perdre ou gagner..
En connaissant le nombre d'électrons de valence, vous pouvez également commencer par la structure de Lewis d'un composé à partir de ces informations. Le tableau périodique permet donc aux étudiants et aux professionnels d'esquisser des structures et de laisser la place à un sondage des géométries et des structures moléculaires possibles..
Tableaux périodiques numériques
Aujourd'hui, la technologie a permis aux tableaux périodiques d'être plus polyvalents et de fournir plus d'informations accessibles à tous. Plusieurs d'entre eux apportent des illustrations frappantes de chaque élément, ainsi qu'un bref résumé de ses principales utilisations.
La façon dont vous interagissez avec eux accélère votre compréhension et votre étude. Le tableau périodique doit être un outil agréable à l'œil, facile à explorer et la méthode la plus efficace pour connaître ses éléments chimiques est de le parcourir de périodes en groupes..
Importance du tableau périodique
Aujourd'hui, le tableau périodique est l'outil d'organisation le plus important en chimie en raison des relations détaillées de ses éléments. Son utilisation est essentielle tant pour les étudiants et les enseignants que pour les chercheurs et de nombreux professionnels dédiés à la branche de la chimie et de l'ingénierie..
En regardant simplement le tableau périodique, vous obtenez rapidement et efficacement une immense quantité et des informations, telles que:
- Le lithium (Li), le béryllium (Be) et le bore (B) conduisent l'électricité.
- Le lithium est un métal alcalin, le béryllium est un métal alcalino-terreux et le bore est un non-métal.
- Le lithium est le meilleur conducteur des trois cités, suivi du béryllium et, enfin, du bore (semi-conducteur).
Ainsi, en localisant ces éléments dans le tableau périodique, leur tendance à la conductivité électrique peut être instantanément conclue..
Les références
- Scerri, E. (2007). Le tableau périodique: son histoire et sa signification. Oxford New York: Presse universitaire d'Oxford.
- Scerri, E. (2011). Le tableau périodique: une très brève introduction. Oxford New York: Presse universitaire d'Oxford.
- Moore, J. (2003). Chimie pour les nuls. New York, NY: pub Wiley.
- Venable, F.P… (1896). Le développement de la loi périodique. Easton, Pennsylvanie: Chemical Publishing Company.
- Ball, P. (2002). Les ingrédients: une visite guidée des éléments. Oxford New York: Presse universitaire d'Oxford.
- Whitten, Davis, Peck et Stanley. Chimie. (8e éd.). Apprentissage CENGAGE.
- Société royale de chimie. (2018). Tableau périodique. Récupéré de: rsc.org
- Richard C. Banks. (Janvier 2001). Le tableau périodique. Récupéré de: chemistry.boisestate.edu
- Physique 2000. (s.f.). L'origine du tableau périodique. Récupéré de: physics.bk.psu.edu
- King K. & Nazarewicz W. (7 juin 2018). Y a-t-il une fin au tableau périodique? Récupéré de: msutoday.msu.edu
- Dr Doug Stewart. (2018). Le tableau périodique. Récupéré de: chemicool.com
- Mendez A. (16 avril 2010). Tableau périodique de Mendeleev. Récupéré de: quimica.laguia2000.com


Personne n'a encore commenté ce post.